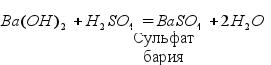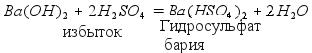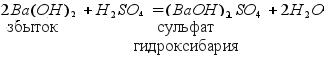|
Занятие №7 Соли. Задание 1. Читайте текст: ЗАПОМНИТЕ: Соли – это сложные вещества, молекулы которых состоят из атомов металла и кислотных остатков. Соли по составу делят на несколько групп. Есть соли средние, кислые и основные: 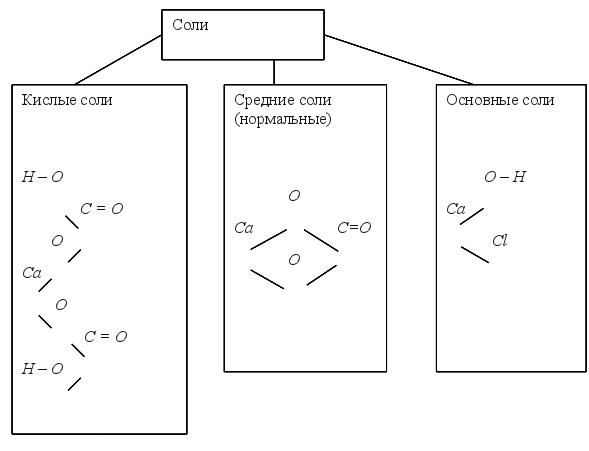
1. Средние соли Задание2.Читайте формулы средних солей: KNO3,AL2(SO4)3,NaAsO4,CuCl2,CaCO3,K2SiO3,FeS,Zn3(PO4)2,FeSO4...Mem+n(X -m)n- общая формула солей. Обратите внимание: Средние (нормальные) соли не содержат в своем составе ни атомов водорода, ни гидроксигрупп. Названия средних солей (смотрите таблицу 7) Обратите внимание: металл имеет постоянную степень окисления: 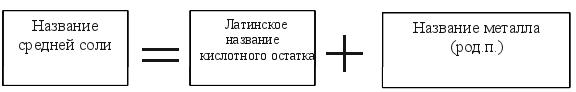
Пример: KNO3 - нитрат (чего?) калия Обратите внимание: металл имеет переменную степень окисления: 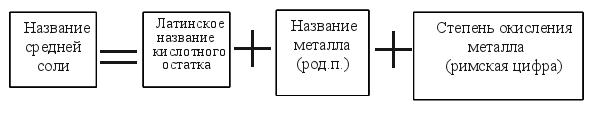
Примеры: Fe2(SO4)3- сульфат железа (III) FeSO4- сульфат железа (II) 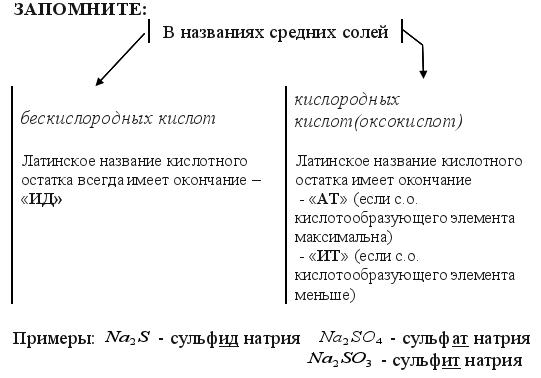
2. Кислые соли (гидросоли) Задание3.Читайте формулы кислых солей: KHCO3,NaHSO4,K2HPO4,Al(H2PO4)3,NaH2PO4,Ca(HCO3)2,Ba(H3P2O7)2,Fe(H2AsO4)3 Обратите внимание: кислые соли содержат в кислотном остатке атомы водорода. Названия кислых солей (смотрите таблицу 7) 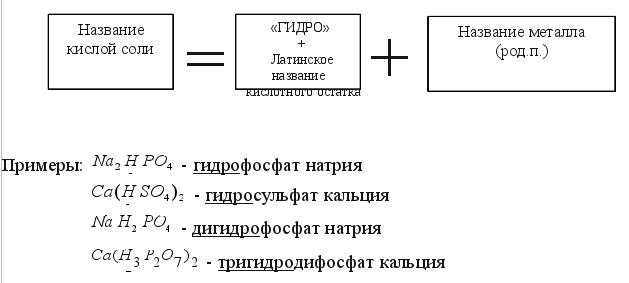
Смотрите названия кислотных остатков средних и кислых солей в таблице 7. 3. Основные соли (гидроксисоли) Задание 4.Читайте формулы основных солей: AlOH(NO3)2,CaOHCl,(ZnOH)2SO4,BaOHNO3,FeOHCl2,(SrOH)3PO4 Обратите внимание: основные соли содержат в своем составе гидроксигруппы OH- . Названия основных солей 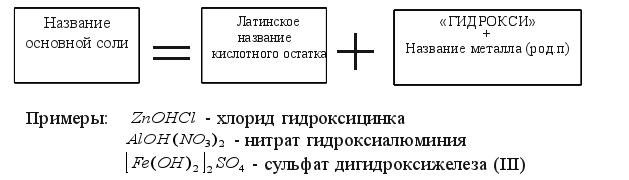
Химические свойства средних солей (смотрите таблицу 8) 1.Реакция с металлами. Соли реагируют с металлами, при этом образуется новая соль и новый металл. (Металл должен быть более активным, чем металл соли) 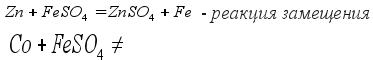
2.Реакция с кислотами. Соли (растворимые и нерастворимые) реагируют с кислотами, при этом образуется новая соль и новая кислота 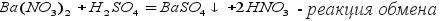
3.Реакция со щелочами. Растворимые соли реагируют со щелочами. При этом образуется новая соль и новое основание. 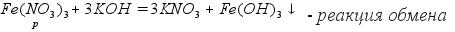
4.Реакция с солями. Две растворимые соли реагируют друг с другом, при этом образуются две новые соли. (В результате реакции нужно получить одну нерастворимую в воде соль) 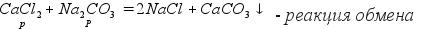
5.Нерастворимые соли при нагревании разлагаются на основной и кислотный оксид 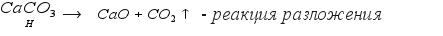
Получение средних солей (смотрите таблицу 8) (Генетическая связь между классами неорганических соединений) Десять основных способов получения солей: 1. Реакция металла и неметалла (реакция соединения): 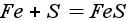
2. Реакция металла и кислоты (реакция замещения): 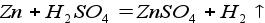
3. Реакция металла и соли (реакция замещения): 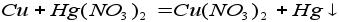
4. Реакция основного и кислотного оксидов: 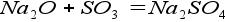
5. Реакция основного оксида и кислоты: 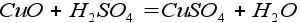
6. Реакция основания и кислотного оксида: 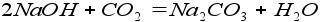
7. Реакция основания и кислоты (реакция нейтрализации): 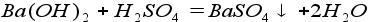
8. Реакция основания(щелочи) и соли (реакция обмена): 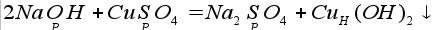
9. Реакция кислоты и соли (реакция обмена): 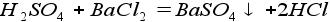
10. Реакция двух солей (реакция обмена): 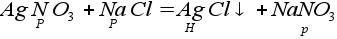
Таблицу 10 «Растворимость кислот, солей и оснований в воде» Обратите внимание: По реакции нейтрализации можно получить три типа солей:
Средние, кислые и основные соли могут превращаться друг друга. Схема превращения солей 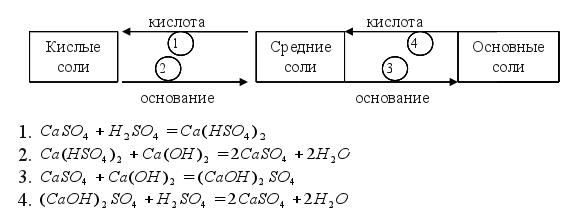
|
|||||||||||