Большая вкусовая гамма и своеобразность ароматов продуктов питания связано с дисперсными частицами разных веществ. Они избирательно действуют на вкусовые рецепторы, и в силу их большого количества в единице массы и большой развитости их поверхности являются идеальными составляющими продуктов питания. Кроме того, вид и состояние дисперсных систем, как составляющих пищевых масс, в первую очередь определяет их физико-механические свойства. Рассмотрение свойств дисперсных систем, на ряду с рассмотрением молекулярного строения и химического состава пищевых материалов, поможет понять механизмы протекания технологических процессов пищевых производств.
3.1. Классификация дисперсных систем.
Дисперсные системы гетерогенны, поэтому имеют широко развитую поверхность, и состоят как минимум из двух фаз. Одна из них является сплошной и называется дисперсионной средой. Другая фаза раздроблена и распределена в первой; ее называют дисперсной фазой. Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсной фазы и дисперсионной среды. Сочетания трех агрегатных состояний (твердое, жидкое и газообразное) позволяют выделить девять типов дисперсных систем (табл. 3.1). Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель—дисперсионной среды, например обозначение Т/Ж показывает, что система состоит из твердой дисперсной фазы и жидкой дисперсионной среды (твердое в жидкости).
Одно из девяти сочетаний Г/Г возможно только при очень высоких давлениях и только для некоторых газов.
Из представленной классификации следует, что все дисперсные системы по кинетическим свойствам дисперсной фазы, можно разделить на два класса: свободнодисперсные системы, в которых дисперсная фаза подвижна; и связнодисперсные системы — системы с твердой дисперсионной средой, в которой частицы дисперсной фазы связаны между собой и не могут свободно перемещаться.
В свою очередь, эти системы классифицируют по степени дисперсности. Для свободнодисперсных и связнодисперсных-систем классификации по дисперсности имеют существенные различия.
Свободнодисперсные системы подразделяют на ультрамикрогетерогенные, размер частиц которых лежит в пределах от 10-7 до 10-5 см, микрогетерогенные с размером частиц от 10-5 до 10-3 см и грубодисперсные с частицами, размер которых превышает 10-3 см.
Таблица 3.1.
Классификация дисперсных систем по агрегатному состоянию фаз
| Дисперсионная среда |
Дисперсная фаза |
Условное обозначение системы |
Название системы и примеры |
| Твердая |
Твердая |
Т/Т |
Твердые гетерогенные системы: минералы, сплавы, бетон, конфетная карамель |
| Твердая |
Жидкая |
Ж/Т |
Капиллярные системы: жидкость в пористых телах, в адсорбентах; пищевые массы пропитанные жидкой средой |
| Твердая |
Газообразная |
Г/Т |
Пористые тела: адсорбенты и катализаторы в газах, гели (сухие стебли, зерно, кожа) |
| Жидкая |
Твердая |
Т/Ж |
Суспензии и золи: пульпы, взвеси, пасты, джемы, осадки из жидкости: |
| Жидкая |
Жидкая |
Ж/Ж |
Эмульсии: кремы, молоко майонезы, маргарины |
| Жидкая |
Газообразная |
Г/Ж |
Газовые эмульсии и пены: флотационные, противопожарные, мыльные пены коктейли, муссы |
| Газообразная |
Твердая |
Т/Г |
Аэрозоли (пыли, дымы), порошки |
| Газообазная |
Жидкая |
Ж/Г |
Аэрозоли: туманы в том числе промышленные, облака |
| Газообразная |
Газообразная |
Г/Г |
Система практически не образуется |
Ультрамикрогетерогенные системы часто называют коллоидными. Частицы в них настолько малы, что вещество, из которого они состоят, почти целиком находится в коллоидном состоянии, т. е. практически содержит только поверхностные атомы и молекулы. Такие частицы по сравнению с отдельной молекулой обладают определенным агрегатным состоянием, которого не имеет молекула. С ростом числа молекул в частице, последняя постепенно приобретает все свойства фазы. В современной литературе ультрамикрогетерогенные системы чаще называют «золями» (нем. Sole от лат. solatia—раствор). Среди них различают твердые золи—системы Т/Т, ими является большинство твердых тел, аэрозоли — золи с газообразной дисперсионной средой; лиозоли—золи с жидкой дисперсионной средой (греч. lies — жидкость). В зависимости oт природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и т. д.
К микрогетерогенным системам относят суспензии (Т/Ж), эмульсии (Ж/Ж), пены (Г/Ж), порошки (Т/Г). Эти системы имеют большое значение в пищевом производстве.. Из грубодисперсных систем наиболее распространены системы Т/Г (в пищевом производстве: сахарный песок, крупы гранулы и др.).
Связнодисперсные системы, точнее, пористые тела, классифицируют на микропористые с размерами пор до 10-7 см, переходнопористые — от 10-7 до 10-5 см и макропористые — выше 10-5 см. Системы Т/Т часто удобнее подразделять по дисперсности так же, как и свободнодисперсные системы. Очевидно, что указанные пределы являются в какой-то степени приближенными и зависят от методов определения и природы объектов исследования. Как правило, все твердые частицы, какие бы размеры они не имели, состоят из частиц коллоидных размеров, сросшихся между собой. В этом также состоит универсальность дисперсного состояния.
Из дисперсных систем в пищевом производстве особый интерес представляют гидрозоли- жидкости, содержащие в устойчивом взвешенном состоянии твердые частицы (суспензии) и нерастворимые в них капли других жидкостей (эмульсии). Явным представителем гидрозолей могут быть джемы, кондитерские кремы, майонез, маргарин и др.
3.2. Физические процессы в дисперсных системах.
Частицы дисперсной фазы под действием кинетической энергии молекул дисперсной среды совершают интенсивное хаотическое молекулярно-тепловое (броуновское) движение. Крупные частицы размером 3...4 мкм при этом совершают колебания около некоторого своего центра — положения в пространстве. Более мелкие частицы колеблются сильнее, а наиболее мелкие коллоидные частицы беспорядочно перемещаются. Каждая из них обладает и определенной кинетической энергией. В результате этого частицы примесей стремятся равномерно распределяться в дисперсионной среде. Вместе с тем на частицы дисперсной фазы действуют силы гравитационного поля. Известно, что силы тяжести, действующие на частицу в среде можно выразить в виде
F = (4/3)pr3 (d1 – d2)q,(3.1.)
где r — усредненный радиус частицы; d1 — плотность дисперсной фазы; d2 — плотность дисперсной среды; q— сила тяжести.
Силы тяжести, пропорциональные кубу радиуса частицы, уравновешиваются диффузными процессами.
Для оценки протекания диффузионных процессов в дисперсных системах подобного типа используется уравнение Эйнштейна
dk = RJ/(Nsprh0),(3.2.)
где Dk — коэффициент диффузии коллоидной системы; R — универсальная газовая постоянная; -J — абсолютная температура; N — число Авогадро; h0 — вязкость дисперсной среды; r — радиус дифундирующих молекул или частиц.
В свою очередь вязкость дисперсионной (коллоидной) среды определяется в зависимости от вязкости дисперсной среды так
h = h0(1 + 2,5j),(3.3)
где j — отношение объема сфероподобных твердых частиц к объему жидкой фазы.
Из этих выражений следует, что коэффициент диффузии обратно пропорционален размеру диффундирующих молекул или частиц. Это означает, что скорость диффузии в коллоидных системах в сотни тысяч раз меньше, чем диффузия молекул в жидкостях или газах.
Помимо гравитационных сил между частицами дисперсной среды в момент сближения частиц (при подлете друг к другу) действуют силы Ван-дер-Ваальса. В зависимости от природы взаимодействующих частиц, их свободной поверхностной энергии и их кинетической энергии, некоторые из них могут образовывать между собой и устойчивыe связи. Процесс укрупнения частиц под действием молекулярных сил получил название коагуляции или слипания частиц. Скоагулированные частицы ускоряют процесс их оседания. Поэтому в общем случае устойчивость дисперсионной системы зависит во времени от размера дисперсионных частиц, их свободной поверхностной энергии, вязкости дисперсионной системы и температуры.
Процесс оседания (расслоения) дисперсионной среды получил название седиментация. Седиментационно устойчивыми бывают системы чаще всего с размером частиц менее 1 мкм, и их характеристики остаются неизменными в течение нескольких месяцев — года. Оседающие из воздуха или жидкости дисперсионные частицы образуют на поверхности твердых тел мелкодисперсные слои со специфическими свойствами. Они достаточно прочно удерживаются на поверхности твердых тел и оказываются способными сильно менять свои структурные свойства и сопротивляться сдвигу со стороны воздействующих на них внешних сил.
Для повышения устойчивости аэрозолей и гидрозолей часто используются специальные покрытия поверхности частиц, например, поверхностно-активными веществами, уменьшающими межмолекулярное взаимодействие между частицам или за счет повышения температуры, приводящей к повышению кинетической энергии частиц, или за счет повышения плотности дисперсионной среды.
В тех же случаях, когда требуется удалить частицы из газа или жидкости, используются методы, способствующие их коагуляции, воздействуют на них внешними силами (электрическими, магнитными, центробежными), используется тонкая фильтрация (например, с по мощью молекулярных сит или мелкодисперсных систем) и др.
3.3. Свободнодисперсные системы.
В свободнодисперсных системах частицы дисперсной фазы могут свободно перемещаться по всему объему дисперсионной среды. Это общее свойство позволяет оценивать некоторые происходящие в таких системах явления с единой позиции. Для всех свободнодисперсных разбавленных систем, в которых движение частиц не осложнено их агрегацией, характерны общие закономерности седиментации (оседание и выделение дисперсной фазы), а также электрокинетических и молекулярно-кинетических свойств. Некоторые различия, не столько качественные, сколько количественные, имеют системы с жидкой и газообразной дисперсионными средами. Они в основном обусловлены меньшими значениями вязкости и плотности газа по сравнению с жидкостью (для газа вязкость меньше в » 50 раз, а плотность в » 100 и более раз) и более сильным взаимодействием жидкости с дисперсной фазой (сольватация). Увеличение дисперсности и концентрации дисперсной фазы может приводить к существенным различиям в некоторых физико-механических свойствах систем, что дает основание для их классификации по этим признакам. Свободнодисперсные системы делят на аэрозоли, порошки, лиозоли, суспензии, эмульсии и пены ( классификацию дисперсных систем см. раздел 3.1.).
Аэрозоли—дисперсные системы с газообразной дисперсионной средой и взвешенными твердыми или жидкими частицами. По методам получения они подразделяются на диспергационные, образующиеся при измельчении и распылении веществ, и на конденсационные, получаемые конденсацией из пересыщенных паров и в результате реакций, протекающих в газовой фазе. По агрегатному состоянию и размерам частиц дисперсной фазы аэрозоли делят на туманы—системы с жидкой дисперсной фазой, размер частиц 10—0,1 мкм, пыли—системы с твердыми частицами размером больше 10 мкм и дымы, размеры твердых частиц которых находятся в пределах 10—0,001 мкм. Туманы имеют частицы правильной сферической формы (результат самопроизвольного уменьшения поверхности жидкости), а пыли и дымы содержат твердые частицы самой разнообразной формы. К типичным аэрозолям относятся: водяной туман (размер частиц 0,5 мкм), топочный дым (0,1—100 мкм), дождевые облака (10—100 мкм), сернокислотный туман (1—10 мкм). Частицы высокодисперсных аэрозолей участвуют в тепловом движении газообразной дисперсионной среды.
Порошки можно рассматривать как осажденные аэрозоли с твердыми частицами. Однако частицы в них могут быть более крупными и достигать в диаметре до 1—2 мм. В зависимости от размеров частиц для порошков приняты разные названия. Например песок (диаметр частиц 0,2—0,002 см), пыль (20—2 мкм). Более мелкие порошки иногда называют пудрой. Размер частиц промышленных порошков определяется их целевым назначением и часто является одним из основных показателей качества продукта. Например, качество муки повышается с увеличением степени помола. Многие важнейшие свойства кремов зависят от дисперсности наполнителей.
По форме частицы в порошках подразделяют на равноосные, имеющие приблизительно одинаковые размеры по трем осям, волокнистые, длина которых значительно больше других размеров, и плоские, длина и ширина которых значительно больше толщины.
Частицы порошка всегда находятся в контакте. Хотя общая поверхность контакта частиц в порошках очень мала, эта особенность определяет важнейшие технологические характеристики порошков, например, текучесть. Текучесть определяют по скорости вытекания порошка через калиброванное отверстие диаметром 1,5—4,0 мм. Текучесть порошка зависит от плотности, размера и формы частиц, состояния их поверхности, влажности и других свойств. Повышение дисперсности приводит к уменьшению текучести вследствие роста общей поверхности контакта. Увеличение влажности также снижает текучесть порошков.
Суспензии—это системы с твердой дисперсной фазой и жидкой дисперсионной средой. Суспензии имеют ряд общих свойств с порошками; эти системы подобны по дисперсности. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензии она снова превращается в порошок. Концентрированные суспензии называют пастами, пульпами, шламами, шликерами. В пищевой промышленности с суспензиями имеют дело, на пример, в виноделии и пивоварении при осаждении или фильтрации осадка из молодого вина и сваренного пива. Суспензию образует разведённый в воде крахмал, не растворившийся сахар в пересыщенном растворе, красители, и многие другие материалы представляют собой суспензии.
В зависимости от дисперсности твердой фазы суспензии подразделяют на грубые (диаметр частиц более 100 мкм), тонкие (от 100 до 0,5 мкм), и мути (от 0,5 мкм до 100 нм). Иногда в эту классификацию включают золи (коллоидные растворы) с размерами частиц менее 100 нм, хотя по ряду специфических признаков они представляют качественно отличающийся вид дисперсных систем.
Лиозоли часто называют истинно коллоидными системами Размеры частиц дисперсной фазы в них не превышают 100 им Основное качественное отличие лиозолей от микрогетерогенных систем состоит в том, что частицы золей участвуют в тепловом движении и благодаря этому обладают многими свойствами истинных растворов.
Лиозоли делят на дисперсионные, ассоциативные и макро-молекулярные. Дисперсионные лиозоли получают методами конденсации (чаще всего) либо диспергирования, ассоциативные—образуются обратимо при ассоциации молекул в растворах (обычно молекул ПАВ). К макромолекулярным лиозолям относятся растворы высокомолекулярных веществ. Лиозоли второй и третьей группы образуются самопроизвольно, как и истинные растворы.
Эмульсии—это дисперсные системы, образованные двумя взаимно нерастворимыми жидкостями. Их получают как конденсационными, так и диспергационными методами. На практике чаще используют диспергирование. Как и суспензии, эмульсии обычно подразделяют по размерам частиц и концентрациям дисперсной фазы.
Дисперсность эмульсий может изменяться в широких пределах вплоть до истинно коллоидной (диаметр частиц менее 100 нм). Большинство эмульсий принадлежит к микрогетерогенным системам (размер частиц >100 нм), и их частицы хорошо видны в обычном микроскопе. Для эмульсий характерна коалесценция капель, т. е. их самопроизвольное слияние. Чтобы получить высокодисперсные и устойчивые эмульсии, в систему добавляют стабилизаторы, называемые в данном случае эмульгаторами.
Для того, чтобы различать, какая из жидкостей эмульсии диспергирована, а какая является дисперсионной средой, принято полярную жидкость условно называть «водой», а неполярную—«маслом». В соответствии с этим эмульсии делят на два типа: прямые—«масло в воде» (м/в) и обратные—«вода в масле» (в/м). Тип эмульсии определяют по свойствам дисперсионной среды. Например, прямые эмульсии (м/в) смешиваются с водой (с полярными жидкостями), имеют большую электропроводность, плохо смачивают гидрофобную поверхность. Противоположными свойствами обладают обратные эмульсии (в/м).
В зависимости от концентрации дисперсной фазы эмульсии делят на разбавленные, концентрированные и высококонцентрированные. Разбавленные эмульсии, имеющие концентрацию дисперсной фазы до 0,1% (об.), отличаются высокой дисперсностью (размер капель может быть менее 100 нм). Концентрация дисперсной фазы в концентрированных эмульсиях не превышает 74% (об.). Это максимальная концентрация, которая соответствует плотной упаковке сферических капель одинакового размера при отсутствии их деформирования. В концентрированных эмульсиях капли постоянно находятся в контакте, и поэтому они устойчивы только в присутствии эмульгатора. Если концентрация дисперсной фазы превышает 74%, то эмульсию называют высококонцентрированной. В таких эмульсиях движение капель почти отсутствует, они существенно деформированы, а дисперсионная среда приобретает вид тонких прослоек—эмульсионных пленок.
Пены и газовые эмульсии—свободнодисперсные системы, состоящие из газообразной дисперсной фазы и жидкой дисперсионной среды. Газовые эмульсии—это разбавленные системы с малым содержанием пузырьков газа в жидкости. Они сравнительно быстро расслаиваются: вследствие значительно меньшей плотности газа по сравнению с жидкостью пузырьки всплывают на поверхность, где, концентрируясь, образуют пену
Пены—концентрированные дисперсные системы типа Г/Ж— имеют значительно большее распространение и значение, чем газовые эмульсии. Они могут быть получены как диспергационными, так и конденсационными методами. Пена получается при барботаже газа в жидкость из узкого отверстия — струя газа разрывается и разбивается на пузырьки. Пена образуется и при механическом перемешивании газа с жидкостью, что можно наблюдать при кипении, мойке и других процессах. Примерами конденсационного метода являются образование пены в газированных напитках насыщенных СО2, при приготовлении молочных коктейлей, при взбивании белков при пользовании пенным огнетушителем. В этих системах пузыри газа образуются в виде новой фазы в результате химической реакции или выделения растворенного газа при повышении температуры или уменьшении давления. Устойчивость пен, как и эмульсий, обеспечивается с помощью стабилизаторов, в качестве которых применяются ПАВ.
Пены характеризуются очень большой полидисперсностью. Размеры пузырьков газа в пене могут значительно превышать размеры частиц суспензий и эмульсий. Пузырьки газа плотно прижаты друг к другу и разделены пенными пленками, которые вначале имеют значительную толщину. Со временем жидкость под действием силы тяжести и капиллярного давления оттекает из пленок в утолщения, находящиеся в местах контакта нескольких пузырьков, и пенные пленки утончаются. Этот процесс идет быстрее в верхних пузырьках, и поэтому с них начинается разрушение пены.
3.4. Связно дисперсные системы.
Найболе важные и распространённые дисперсные системы – твёрдые тела, относятся к связнодисперсным системам, т. е. К системам с твёрдой дисперсной средой. Для этих тел устойчивость и коагуляция не столь характерны. Всё же в лиофобных (не смачиваемых) твёрдых дисперсных системах протекают процессы , хотя и очень медленно, сопровождающиеся уменьшением поверхностной энергии, Например медленные процессы перекристализации, изотермической перегонки их относят к процессам старения материалов). Более быстро эти процессы протекают в пористых телах, особенно при наличии жидкой фазы, когда возможна хотябы небольшая растворимость.
В соответствии со сказанным выше лиофобные твёрдые дисперсные системы можно рассматривать как кинетически устойчивые системы, имеющие дисперсионную среду с бесконечно большой вязкостью. Вместе с тем их можно представить и как уже скоагулированные системы со сформировавшейся обьёмной структурой. Такое представление отвечает методам получения большинства твёрдых материалов, поскольку они обычно образуются из свободнодисперсных систем лиофильные твёрдые дисперсные системы (стабилизированные) отличаются значительной стабильностью свойств во времени.
Связнодисперстные системы составляют основу большинства пищевых масс и в сочетании с свободнодисперстными системами составляют всё разнообразие пищевых материалов создаваемых и перерабатываемых в пищевом производстве.
3.5. Процессы в дисперсных системах и агрегативная устойчивость.Процессы в дисперсных системах обуславливают их формирование живучесть и приобретаемые свойства, они определяют технологические процессы получения и обработки большенства пищевых масс и являются основными в пищевом производстве.
3.5.1. Проблема устойчивости дисперсных систем пищевых материалов. Под устойчивостью дисперсных систем понимают постоянство их свойств во времени и в первую очередь дисперсности, распределения по объему частиц дисперсной фазы и межчастичного взаимодействия. В данном определении имеется в виду устойчивость по отношению к укрупнению или агрегации частиц дисперсной фазы и к их осаждению. Все эти процессы характерны для свободнодисперсных систем пищевых материалов, хотя укрупнение частиц в определенных условиях возможно и в связнодисперсных системах составляющих основу некоторых пищевых продуктов.
Проблема устойчивости дисперсных систем является одной из важнейших в технологических процессах пищевых производств. Обеспечение устойчивости свободнодисперсных систем необходимо при получении и обеспечении возможности длительного сохранения свойств пищевых продуктов, покрытий, связующих материалов, лекарственных препаратов, аэрозольных средств и т. д. Ликвидация же устойчивости требуется для того, чтобы вызвать. структурообразование в пищевых материалах, при выделении осадков, для разделении фаз, очистке жидких систем и др.
Устойчивость дисперсных систем подразделяют на два вида: устойчивость к осаждению дисперсной фазы и устойчивость к агрегации ее частиц.
3.5.2. Закономерности седиментации свободно дисперсных систем пищевых материалов. Первый вид устойчивости, характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды, или ее устойчивость к разделению фаз (седиментационная устойчивость).
Характерным общим свойством суспензий, порошков, эмульсий и аэрозолей, особенно если они разбавлены, является склонность к оседанию или всплыванию частиц дисперсной фазы. Оседание частиц дисперсной фазы называется седиментацией, а всплывание частиц—обратной седиментацией.
На каждую частицу в системе действует сила тяжести (гравитационная сила) и подъемная сила Архимеда:
F=mg=vrg и FА=vrog (3.4.)
где т и v — масса и объем частицы; g — ускорение свободного падения; r, rо — плотность частиц дисперсной фазы и дисперсионной среды соответственно.
Эти силы постоянны и направлены в разные стороны. Равнодействующая сила, вызывающая седиментацию, равна
Fсед=F-FА=mотg=v(r—rо)g (3.5.)
где mот—относительная масса частицы (с учетом плотности среды,mот=m—vrо).
Если r>rо, то Fсед>0, и частица оседает, если r<rо, то Fсед<0, и частица всплывает, т.е. происходит обратная седиментация, характерная для газовых и большинства жидких эмульсий.
На седиментацию малых частиц в жидких средах влияет их сольватация, и её необходимо учитывать, для частиц с размером <1 мкм. Следует принимать также во внимание и плотность сольватного слоя.
Оценка дисперсности пищевых материалов играет важную роль в пищевом производстве. Анализ дисперсности веществ люди проводили сдревних времён. Так, дя оценки вкусовых качеств муки, оценивали её дисперсность, которую в те времена проводили на ощупь. В настоящее время дисперсность служит одним из основных технологических параметров веществ и материалов во многих производствах. Разработаны различные методы дисперсного анализа, из которых найболее простой и распростанённый метод – седиментационный
3.5.3. Агрегативная устойчивость дисперсных систем пищевых материалов. Рассмотрим явления и процессы, обусловленные агрегативной устойчивостью – второй вид устойчивости дисперсных систем. Прежде всего отметим, что все дисперсные системы в зависимсоти от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободнодисперсной системы).
Лиофобные системы по определению должны обладать избытком поверхностной энергии, если последняя не скомпенсирована введением стабилизаторов. Поэтому в них самопроизвольно идут процессы укрупнения частиц, т. е. происходит снижение поверхностной энергии за счет уменьшения удельной поверхности. Такие системы называют агрегативно неустойчивыми.
Укрупнение частиц может идти двумя путями. Один из них,. называемый изотермической перегонкой, заключается в переносе вещества от мелких частиц к крупным, так как химический потенциал последних меньше (эффект Кельвина). В результате мелкие частицы постепенно растворяются (испаряются), а крупные—растут. Второй путь, наиболее характерный и общий для дисперсных систем, представляет собой коагуляцию (от лат, свертывание, затвердение), заключающуюся в слипании и слиянии частиц. В общем смысле под коагуляцией понимают потерю агрегативной устойчивости дисперсной системой.
Коагуляция в разбавленных системах приводит к потере седиментационной устойчивости и в конечном итоге к расслоению (разделению) фаз. К процессу коагуляции относят адгезионное взаимодействие частиц дисперсной фазы с макроповерхностями (адагуляция). В более узком смысле коагуляцией называют слипание частиц, процесс слияния частиц получил название коалесценции. В концентрированных системах коагуляция может проявляться в образовании объемной структуры, в которой равномерно распределена дисперсионная среда. В соответствии с двумя разными результатами коагуляции различаются и методы наблюдения и фиксирования этого процесса. Укрупнение частиц ведет, например, к увеличению мутности раствора, уменьшению осмотического давления. Структурообразование изменяет реологические свойства системы, например, возрастает вязкость, замедляется ее течение.
Чтобы нагляднее представить основные процессы, которые могут происходить в дисперсных системах, на рис. 3.1 показана схема переходов дисперсных систем в разные состояния. Устойчивая свободнодисперсная система, в которой дисперсная фаза равномерно распределена по всему объему, может образоваться в результате конденсации из истинного раствора. Потеря агрегативной устойчивости приводит к коагуляции, первый этап которой состоит в сближении частиц дисперсной фазы и взаимной их фиксации на небольших расстояниях друг от друга. Между частицами остаются прослойки среды. В результате образуются или флокулы (флокуляция—образование агрегатов из нескольких частиц, разделенных прослойками среды), или коагуляционные структуры, отличающиеся подвижностью частиц относительно друг друга под действием сравнительно небольших нагрузок (места контактов разделены прослойками среды). Обратный процесс образования устойчивой свободнодисперсной системы из осадка или геля (структурированной дисперсной системы) называется пептизацией.
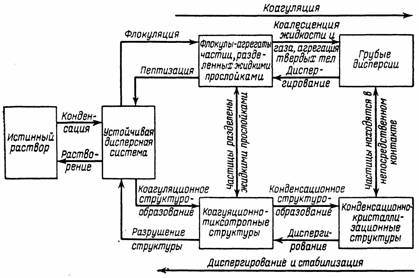
Рис. 3.1. Процессы, протекающие в дисперсных системах.
Более глубокий процесс коагуляции приводит к разрушению прослоек среды и непосредственному контакту частиц. В итоге или образуются жесткие агрегаты из твердых частиц, или происходит полное слияние их в системах с жидкой или газообразной дисперсной фазой (коалесценция). В концентрированных системах образуются жесткие объемные конденсационные структуры твердых тел, которые снова можно превратить в свободнодисперсную систему только с помощью диспергирования (принудительного). Таким образом, понятие коагуляции включает в себя несколько процессов, идущих с уменьшением удельной поверхности системы.
Агрегативная устойчивость нестабилизированных лиофобных дисперсных систем носит кинетический характер, и судить о ней можно по скорости процессов, вызываемых избытком поверхностной энергии. При изотермической перегонке агрегативная устойчивость определяется скоростью массопереноса от мелких частиц к крупным. Скорость коагуляции определяет агрегативную устойчивость дисперсной системы, для которой характерен процесс слипания (слияния) частиц.
Агрегативная устойчивость может носить и термодинамический характер, если дисперсная система не обладает избытком поверхностной энергии. В такой дисперсной системе поверхностная энергия скомпенсирована энтропийной составляющей, благодаря чему система проявляет термодинамическую агрегативную устойчивость и в ней не происходит процесс коагуляции.
3.5.4. Виды и факторы агрегативной устойчивости. Различают термодинамически агрегативно устойчивые системы и системы термодинамически устойчивые к коагуляции. Лиофильные системы термодинамически агрегативно устойчивы, они образуются самопроизвольно и для них процесс коагуляции вообще не характерен. В то же время лиофобные стабилизированные системы термодинамически устойчивы к коагуляции; они могут быть выведены из такого состояния с помощью воздействий, приводящих к избытку поверхностной энергии (нарушение стабилизации). Очевидно, что термодинамически устойчивые к коагуляции системы являются термодинамически неустойчивыми к изотермической перегонке.
В соответствии с вышеизложенной классификацией различают термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем. Так как движущей силой коагуляции является избыточная поверхностная энергия, то основными факторами, обеспечивающими устойчивость дисперсных систем (при сохранении размера поверхности), будут те, которые снижают поверхностное натяжение. Эти факторы относят к термодинамическим. Они уменьшают вероятность эффективных. соударений между частицами, создают потенциальные барьеры, замедляющие или даже исключающие процесс коагуляции. Чем меньше поверхностное натяжение, тем ближе система к термодинамически устойчивой. Однако это совсем не значит, что в агрегативно неустойчивой системе с уменьшением поверхностного натяжения обязательно снижается скорость коагуляции, так как последняя зависит, кроме того, и от кинетических факторов.
Кинетические факторы, снижающие скорость коагуляции, связаны в основном с гидродинамическими свойствами среды: с замедлением сближения частиц, вытекания и разрушения прослоек среды между ними.
Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем.
Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц. Появление электрического потенциала на межфазной поверхности обусловливается поверхностной электролитической диссоциацией или адсорбцией электролитов.
Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации).
Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении. Сущность его состоит в стремлении дисперсной фазы к равномерному распределению по объему системы (как и распределение растворенного вещества в истинных растворах).
Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени. В этом смысле сюда можно отнести и первые два фактора, способствующие образованию упругих поверхностных слоев.
Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно. Особенно высокая устойчивость наблюдается при совокупности действия термодинамических и кинетических факторов, когда наряду со снижением межфазного натяжения проявляются структурно-механические свойства межчастичных прослоек.
Необходимо иметь в виду, что каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, действие электростатического фактора значительно снижается при введении в систему электролитов, которые вызывают сжатие двойного электрического слоя. Сольватация при адсорбционно-сольватном факторе может быть исключена лиофобизацией частиц дисперсной фазы с помощью адсорбции соответствующих веществ. Действие структурно-механического фактора можно уменьшить с помощью веществ, разжижающих и растворяющих упругие структурированные слои на поверхности частиц.
3.5.5. Структура дисперсных систем и физико-механические свойства. Связывая рассматриваемый материал с изложенным в предыдущих частях пособия, необходимо остоновиться на физико-механических свойствах дисперсных систем.
Под структурой тел обычно понимают пространственное взаимное расположение составных частей тела: атомов, молекул, мелких частиц. Структура разбавленных агрегативно устойчивых дисперсных систем по ряду свойств очень похожа на структуру истинных растворов. Основное отличие состоит в том, что в дисперсных (гетерогенных) системах частицы дисперсной фазы и молекулы дисперсионной среды сильно различаются по размерам. Увеличение концентрации дисперсной фазы приводит к взаимодействию её частиц, подобному ассоциации молекул и ионов в истинных растворах. Изменение свойств дисперсных систем с ростом концентрации происходит постепенно до тех пор, пока не наступит коагуляция частиц. В коллоидной химии, которая в основном и занимается дисперсными системами, понятия структуры и структурообразования принято связывать именно с коагуляцией. В процессе коагуляции происходит образование пространственной структурной сетки из частиц дисперсной фазы, что резко увеличивает прочность системы.
Таким образом, структурообразование в свободнодисперсных системах есть результат потери их агрегативной устойчивости. По мере увеличения прочности структуры свободнодисперсная система переходит в связнодисперсную систему. Появление и характер образующихся структур, как правило, определяют по механическим свойствам систем, к важнейшим из которых относятся вязкость, упругость, пластичность, прочность. Этот класс свойств непосредственно связан со структурой тел, и их обычно называют структурно-механическими, которые входят в состав общих физико-механических свойств.
Физико-механические свойства систем исследуют методами реологии — науки о деформациях и течении материальных систем. Реология изучает механические свойства систем по проявлению деформации под действием внешних напряжений. Это подробно уже было рассмотрено в первых двух частях пособия, и в завершение изложенного выше можно привести некоторые сведения о свойствах дисперсных систем разного вида и происхождения.
Широкий спектр физико-механических свойств отражает многообразие пищевых материалов, являющихся дисперсными системами со всевозможной комбинацией фаз, различающихся природой и агрегатным состоянием, размером частиц и взаимодействиями между ними. Поэтому эти свойства дисперсных систем представляются непрерывным и бесконечным рядом не только промежуточных, аддитивно складываемых свойств, но и качественно новых, не присущих отдельным компонентам. Умение управлять процессами, протекающими в дисперсных системах, открывает неограниченные возможности для получения пищевых материлов с заданными свойствами.
Многообразие свойств различных структур дисперсных систем П. А. Ребиндер разделил на два основных класса, различающихся по видам взаимодействия частиц дисперсной фазы. Исходя из того, что коагуляция соответствует первичному и вторичному минимуму потенциальной кривой взаимодействия частиц, он предложил различать на конденсационно-кристаллизационные и коагуляционные структуры. Конденсационно-кристаллизационное структурообразование, отвечающее коагуляции в первичном потенциальном минимуме, осуществляется путем непосредственного химического взаимодействия между частицами и их срастания с образованием жесткой объемной структуры. Если частицы аморфные, то структуры, образующиеся в дисперсных системах, принято называть конденсационными, если частицы кристаллические, то структуры являются кристаллизационными. При непосредственном срастании частиц механические свойства структур соответствуют свойствам самих частиц. Конденсационно-кристаллизационные структуры типичны для связнодисперсных систем, т. е. систем с твердой дисперсионной средой. Такие структуры придают телам прочность, хрупкость и не восстанавливаются после разрушения.
Под коагуляционными структурами понимают структуры, которые образуются при коагуляции, соответствующей вторичному минимуму потенциальной кривой взаимодействия частиц дисперсной фазы (хотя конденсационно-кристаллизационные структуры также формируются в результате коагуляции). При образовании коагуляционных структур взаимодействие частиц, осуществляемое через прослойки дисперсионной среды, является, как правило, Ван-дер-Ваальсовым, и поэтому пространственный каркас такой структуры не может отличаться высокой прочностью. Механические свойства коагуляционных структур определяются не столько свойствами частиц, образующих структуру, сколько характером и особенностями межчастичных связей и прослоек среды. Коагуляционные структуры имеют обычно жидкую дисперсионную среду. Для них характерна способность восстанавливать структуру во времени после ее механического разрушения. Это явление получило название тиксотропии. Соответственно подобные структуры часто еще называют коагуляционно-тиксотропными.
Самопроизвольное восстановление коагуляционной структуры свидетельствует о том, что она обладает наибольшей механической прочностью при относительном минимуме энергии Гиббса. Такое соответствие отсутствует у конденсационно-кристаллизационных структур, которые образуются обычно в условиях высоких пересыщений и поэтому термодинамически неустойчивы. Их высокая прочность обеспечивается одновременным уменьшением пересыщения и снижением внутренних напряжений.
В пищевом производстве используют реальные тела с разнообразной структурой. Как правило, большинство из них являются твердыми телами, имеющими конденсационно-кристаллизационные структуры, а сырье и промежуточные продукты чаще всего представляют собой жидкообразные или твердообразные системы с коагуляционной структурой. Последние очень удобны в пищевом производстве, поскольку обеспечивают возможность регулирования состава и однородности, регулировать процессы формования и др.
Разнообразие свойств в реальных дисперсных системах пищевых материалов не позволяет чётко разделить их на два указанных вида. Безусловно существует множество промежуточных состояний систем. И всё же предложенная П.А. Ребиндером классификация структур дисперсных систем помогает связать состав и строение тел с физико-механическими свойствами, но это подробно уже рассмотрено в первых частях пособия.