Глава 1 Молекулярное строение и свойства тел пищевых масс.
1.1.Характер взаимодействия между атомами, ионами и молекулами определяющий физико-механические свойства пищевых масс.
Пищевые массы и обрабатываемые их машины и оборудование представляют из себя твёрдые жидкие и газообразные материалы. Основа же строения и физико-механические свойства этих материалов определяются характером взаимодействия между структурными частицами (атомами, ионами и молекулами), из которых они состоят и на действие которых способны оказывать влияние окружающая среда и процессы, связанные с их технологической обработкой. В свою очередь выбор процессов технологической обработки, выбор конструкции и параметров рабочих органов определяется физической структурой и характером взаимодействия элементарных частиц, Чтобы понимать процессы, протекающие в пищевых массах при их технологической обработке и управлять ими, необходимо иметь о них возможно более полное представление.
Атомы, ионы и молекулы несут в себе электрические положительные и отрицательные заряды разной величины и по разному удалены друг относительно друга. В общем случае, независимо от природы их взаимодействия (ионной ковалентной, металлической или молекулярной связи), им свойственен качественно общий ход изменения сил взаимодействия и потенциальной энергии с изменением расстояния между взаимодействующими структурными частицами.
Для первоначально электрически нейтральных и уже заряженных частиц (например, ионов) характерно проявление сил притяжения Fnp при удалении друг от друга на расстояние равное 2...3 их диаметрам, которые при приближении частиц
При приближении же структурных частиц на расстояние равное 1...2 их диаметрам между одноименными электрическими зарядами начинают действовать силы отталкивания Foт. которые резко увеличиваются с последующим уменьшением расстояния между частицами.
Результирующая сила взаимодействия между структурными частицами Fрез в этом случае определяется
Fрез=Fот –Fпр. (1.1)
Минимум потенциальной энергии располагается на расстоянии между частицами rо, при котором силы притяжения становятся равными силам отталкивания.
Под действием сил взаимодействия при температуре, соответствующей абсолютному нулю градусов Цельсия, структурные частицы стремятся занять в пространстве места, соответствующие потенциальной энергии. Для одних групп частиц этот минимум потенциальной энергии будет большим, для других меньшим, так как зависит от вида связи (табл. 1,1). Для одних он будет иметь большее значение, для других — меньшее на расстоянии равном размеру частиц r0.
Таблица 1.1
Энергия разрыва для разных видов связи
| Вид связи |
Энергия разрыва, эВ |
| Ионная Ковалентная Металлическая Ван-дер-Ваальсова |
9 - 7,5 6,5 - 5,5 3 – 2 0,1 |
Непременной особенностью при этом остается то, что на расстояниях, меньших чем rо, преимущественное воздействие при взаимодействии материальных частиц оказывают силы отталкивания, а на расстояниях, больших чем rо, действуют силы притяжения.
Общий вид изменения этих схематичных зависимостей представлен на рис.1.1.
>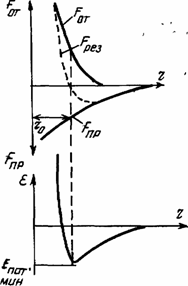
Рис 1.1. Силы и потенциальная энергия взаимодействия между двумя частицами вещества в зависимости от расстояния между ними.
Окружающие нас тела имеют температуру, существенно отличную от абсолютного нуля. Кроме того, в процессе технологической обработки в зоне контакта с рабочими органами выделяется дополнительное тепло и, как следствие, происходит дополнительное повышение температуры. Поэтому необходимо учитывать еще и кинетическую энергию Екии, прямо связанную с температурой частиц, которая на одну степень их свободы имеет величину, равную
Екии= -1/2 - kJt,(1.2)
где k — постоянная Больцмана; J — абсолютная температура.
В зависимости от соотношения между минимальной потенциальной энергией Епот.мин и Екин группы взаимодействующих частиц образуют твердые тела, жидкости или газы, а также во многом определяют их свойства.
В твердых телах Епот.мин >>Екин и частицы, их образующие, совершают колебательное движение вблизи своего мгновенного центра равновесия (несколько больше, чем rо), испытывая при этом воздействие как сил отталкивания, так и сил притяжения.
В условиях, когда Екин при окружающих нас температурах по |соей величине приближается к –Епот.мин, частицы совершают уже весьма значительные колебательные движения, испытывая при этом как действие сил отталкивания, так и сил притяжения, но уже значительно меньших, чем у твердых тел. Этот вид взаимодействия между частицами становится характерным для жидкости.
В условиях, когда при окружающих нас температурах Екин>>Епот.мин., что наблюдается у газов, основным видом взаимодействия между частицами становятся силы отталкивания. Это определяет и свойства газов. Изменения агрегатного состояния вещества и его свойств могут происходить как за счет изменения свойств взаимодействующих |молекул при некоторой неизменной температуре среды, так и при (достаточно большой Епот.мин, характерной, например, для многих твердых тел только за счет увеличения Екин. связанной только с повышением температуры тела (рис. 1.2).
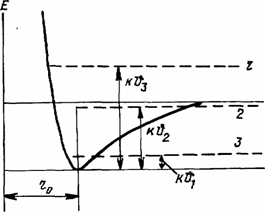
Рис. 1.2. Энергия взаимодействия между частицами вещества, обусловленная изменением температуры.
С повышением (понижением) температуры помимо изменения фазового состояния пищевых материалов с характерными для них свойствами, могут происходить и термомеханические процессы, инициироваться протекание химических реакций и ряд других явлений, способных оказывать дополнительное значительное влияние на механические и химические свойства обрабатываемых материалов.
По своей величине силы Ван-дер-Ваальса значительно меньше ионных или ковалентных сил (см. табл. 1.1), однако они обладают некоторыми уникальными свойствами, которые в определенных ситуациях делают их доминирующими. Прежде всего, Ван-дер-ваальсовы силы можно рассматривать как универсальные и сохраняющие значительную величину даже при сравнительно больших, расстояниях между молекулами (до 1 мкм). Они часто определяют не только взаимодействие между твердыми телами, но и процессы, протекающие на их поверхностях раздела. Среди них такие, например, как физическая адсорбция, смачивание поверхностей, адгезионное взаимодействие, формирование поверхностных слоев, устойчивость коллоидов: пен, кремов студней и др.
1.2.Молекулярное строение поверхности и свойства твердых тел, жидкостей и газов
Пищевые продукты, употребляемые человеком в естественном или приготовленном виде представляют собой сложную комбинацию твёрдых, жидких, и газообразных веществ и естественно свойствами этих компонентов определяются все свойства пищевых масс.
1.2.1. Твердые тела. В процессе конденсации, при формировании вещества, частицы вещества стремятся занять места в пространстве, соответствующие их минимуму потенциальной энергии. Сконденсированные тела, приобретшие упругие свойства, получили название твердых тел. В зависимости от характера взаимодействия и свойств твердые тела разделяют на кристаллические и аморфные.
Для кристаллических тел, например, для снежинки, соли или сахара, характерным являются далеко распространенные строго направленные связи с вполне определенными расстояниями и силами взаимодействия между частицами, образующими единую кристаллическую решетку вещества, получившего название монокристалла. Наименьшим элементом кристалла, достаточно полно отражающим его свойства в трех направлениях, является элементарная (кристаллографическая) ячейка. Наиболее распространенными ячейками являются (рис. 1.3) гранецентрированная кубическая (ГЦК), объемно-центрированная кубическая (ОЦК) и гексоганальная плотноупакованная (ГПУ).
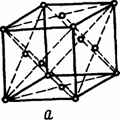
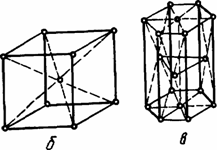
а - гцк; б - оцк; в – гпу
В монокристалле твердого тела механические и другие его свойства во многом определяются межатомными расстояниями в разных направлениях. Так, на плоской модели кристалла (рис. 1.4) постоянная решетки Ь < с < а. Это означает, что прочность на разрыв в нем через плоскость, проходящую перпендикулярно плоскости чертежа, и ось 0В меньше, чем через плоскости, проходящие вдоль ОС и ОА. Она у кристаллов может меняться от нескольких процентов до нескольких раз. Благодаря этому у многих кристаллов имеются явно выраженные слабые и сильные плоскости скольжения, по разному реагирующие на воздействие внешних сил. И модули упругости Юнга у монокристалла, в трех пространственных направлениях, могут быть разными. Часто для определения пространственных сильных и слабых направлений главных плоскостей кристаллитов используют индексы Миллера (рис1.5).
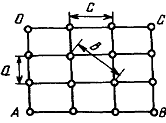
Рис. 1.4. Анизотропия свойств кристаллических тел
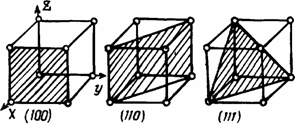
Рис. 1.5. Иидексы Миллера для главных плоскостей кубического кристалла
Явление неоднородности структурных физических и других свойств в разных направлениях кристаллов получило название анизотропия свойств материала. В тех же случаях, когда различие в структуре физических и других свойств в разных направлениях у тел не наблюдается, явление получило название изотропия.
В условиях, когда при производстве сахара, в выпариваемом объеме сахарного сиропа одновременно зарождается множество произвольно ориентированных монокристаллов. Образующееся в таких условиях твердое тело (поликристалл) представляет собой конгломерат сросшихся меду собой беспорядочных кристаллов неопределенной формы (кристаллитов) с размерами частиц от 1 до 3 мм. В поликристалле кристаллиты отделены друг от друга межкристаллической прослойкой, в которой несколько нарушается порядок расположения атомов (рис. 1.6). И если в каждом из кристаллитов наблюдается явно выраженная анизотропия его свойств, то поликристалл в целом обладает некоторой усредненной однородностью физических свойств в разных направлениях.
Рис. 1.6. Схематическое изображение межкристаллических прослоек в поликристалле.
Характерным для кристаллических тел при нагреве их до температуры плавления является необходимость подвода дополнительного тепла, потребного для разрушения кристаллической решетки и выделения определенного его количества равного скрытой теплоте плавления при кристаллизации твердых тел.
У аморфных тел межатомные связи распространяются на небольшие расстояния и взаимная ориентация сохраняется только между ближайшими частицами, (рис. 1.7). Аморфные тела, по своей структуре в известной степени напоминающие жидкость, отличаются от последней лишь меньшим межатомным расстоянием и подвижностью атомов. Им свойственна изотропия (однородность) физических и других свойств в разных направлениях. Переход из жидкого в твердое состояние происходит у подобных тел монотонно (без скачка температур). Характерными представителями аморфных тел являются карамели, многие полимеры и т.п.
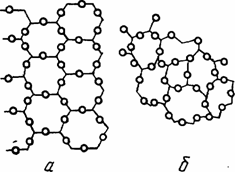
Рис.. 1.7. Схематическое изображение внутреннего строения тел:
а — кристаллических; б — аморфных.
Для одних и тех же материалов, температур и давлений аморфные тела имеют больший удельный объем, большую внутреннюю энергию (за счет нескомпенсированных связей) и большую энтропию по сравнению с такой же массой кристаллических тел.
1.2.2. Дефекты структуры твердых тел. Используя сведения о структуре кристаллического твердого тела и о материале его частиц, представляется возможность рассчитать их прочность. Расчеты для ряда реальных тел показывают, что теоретическая прочность в 100...1000 раз отличается от прочности, реализуемой реальными телами. Причиной тому являются дефекты структуры этих тел. Среди них наиболее распространенными являются: точечные дефекты, линейные дефекты, поверхностные неоднородности и как общий случай, объемные неоднородности материала.
Объемные (трехмерные) неоднородности представляют собой межкристаллические области, внутренние поры и трещины, поверхности вблизи всевозможных включений и т.п.
В общем случае микроструктура реальных тел и их поверхность имеют крайне неоднородное строение (рис. 1.8.) и сложный профиль поверхности на субмикроуровне поликристаллов (рис. 1.9.).
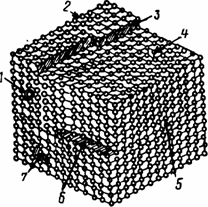
Рис. 1.8. Дефекты строения поверхности реального монокристалла:
1— примесный атом на поверхности; 2— ребро; 3— ступенька; 4— адсорбированный ион; 5— краевая дислокация; 6— винтовая дислокация 7— молекулярная впадина
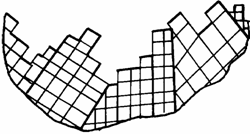
Рис. 1.9. Схема микрогеометрического профиля поверхности твердого тела
Эти дефекты структуры материала и поверхности твердых тел в своей основе имеют размеры, соизмеримые с постоянными кристаллической решетки (10-9 10-8 м), являются незаметными для визуального наблюдения и даже с помощью оптического микроскопа. Однако, они оказываются способными влиять на многие свойства пищевых материалов.
1.2.3. Свободная поверхностная энергия твердых тел. Атомы, ионы и молекулы, находящиеся внутри твердого тела испытывают со стороны окружающих их частиц силовое взаимодействие во всех возможных направлениях, причем результирующая этих сил стремиться к нулю, а сами частицы занимают положение, соответствующее минимуму их потенциальной энергии. Частицы же твердого тела, находящиеся на границе раздела с другой фазой, например, вакуумом, газом или жидкостью, где часто частиц нет вообще или они находятся в значительно меньшей концентрации, имеют полностью или частично нескомпенсированные связи, направленные в сторону этой среды и испытывают избыточное силовое воздействие со стороны твердого (жидкого) тела, которое стремиться как бы втянуть частицы поверхностного слоя внутрь более плотной среды.
Наличие нескомпенсированных молекулярных сил у частиц поверхностного слоя свидетельствует о том, что они обладают из6ыточной энергией по сравнению с аналогичными им частицами, находящимися в объеме. Эта энергия получила название избыточной свободной энергии, а будучи отнесенной к единице поверхности — удельной поверхностной энергии. Благодаря этому частицы, находящиеся на поверхности раздела фаз, занимают подобно жидкости, менее выгодное энергетическое положение. Однако, в отличие от жидкостей, их частицы закреплены в пространстве и не могут свободно перемещаться. Электрические поля свободной поверхностной энергии твердых тел являются дискретными вдоль поверхности твердого тела и по величине чувствительны к строению (анизотропной структуре) твердых тел. Экспериментальное определение свободной поверхностной энергии твердых тел крайне затруднительно. Считается, что в первом приближении свободная поверхностная энергия равна 1/6 энергии сублимации (энергии, необходимой для перевода вещества из твердого в газообразное состояние), т.е. разделения его на независимые атомы.
Вместе с тем, как известно, наибольшая плотность свободной поверхностной энергии наблюдается во впадинах поверхностного слоя твердых тел (микротрещинах, вблизи дефектов структуры, на выходах дислокации, в межкристаллитых областях и т.п ), а наименьшая — на выступах поверхности. Спонтанно же намагниченные отдельные домены поверхностного слоя приводят и к аномалии магнитного поля у поверхности твердого тела.
Свободная поверхностная энергия, субмикроскопические дефекты структуры и поверхности твердых тел, аномальные электрические и магнитные поля способны оказывать существенное влияние на взаимодействие с окружающими материалами, приводить к новым процессам на поверхности тел и, в конечном счете, на изменение их тепло-физических и механических свойств исходных твердых материалов.
1.2.4. Классификация поверхностных явлений. Поверхностные явления удобно классифицировать с позиций термодинамики, которая учитывает основные виды энергии преобразующиеся на поверхности раздела фаз. Общее приращение энергии (энергии Гиббса) системы выражается через алгебраическую сумму приращений других видов энергии: в теплоту; в химическую энергию; в механическую энергию; в электрическую энергию. Превращение поверхностной энергии в один из представленных видов энергии отвечает определенным поверхностным явлениям, таким как изменение реакционной способности с изменением дисперсности, адгезия и смачивание, капиллярность, адсорбция, электрические явления.
1.2.5. Специфические особенности полимерных материалов. Большинство пищевых масс растительного происхождения. Например, такой исходный продукт, как зерно, представляет собой гель, твёрдыми фазами которого являются биополимерные вещества, обладающие всеми свойствами типичных полимеров.
Полимеры состоят из гигантских молекул, образующихся в результате объединения небольших групп атомов, чаще всего атомов углерода и водорода (ковалентная связь). Линейные (и разветвленные) полимеры имеют макромолекулы, состоящие из сотен и тысяч таких групп (рис. 1.10). Между макромолекулами действуют силы Ван-дер-Ваальса (см. табл. 1.1). Большинство полимеров относятся к термопластичным, при повышении температуры они постепенно размягчаются, т.е. ведут себя как аморфные вещества. Вместе с тем, при комнатной температуре у некоторых полимеров имеется частично кристаллическая структура в виде небольших областей, в которых молекулы расположены в определенном порядке
а![]() б
б![]()
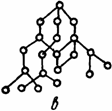
Рис 1 10. Строение высокомолекулярных соединений:
а — линейное; б — разветвленное; в — сетчатое
Другой вид линейные полимеры. К линейным полимерам относятся растительная клетчатка, составляющая основу плодов и овощных продуктов. Механические свойства полимеров отличаются от металлов. Модуль упругости у них в десятки раз меньше и деформация не подчиняется закону Гука, поскольку зависимость деформации от напряжения нелинейна. Полимеры обнаруживают заметную ползучесть даже при комнатной температуре. Поэтому для оценки механических свойств полимеров пользуются «условными» значениями модуля упругости и твердости, определяемыми по специальной методике и существенно зависящими от приложенного напряжения, температуры и скорости деформации.
1.2.6. Газы. Большинство пищевых продуктов в своём составе содержат газы, обрабатываются и хранятся в атмосферных условиях, в своей основе состоящих из газов. В свою очередь газы часто используются в технологических процессах в качестве рыхлителя и наполнителя, а также, в качестве нагревающих и охлаждающих систем. Вместе с тем, газы являются способными взаимодействовать (физически, химически и механически) с твердыми телами и жидкостями, существенно изменяя их свойства. Все вместе это заслуживает обращения особого внимания на свойства газовых систем (основных их закономерностей).
Газы представляют собой систему молекул, удаленных друг от друга на расстояния, в десятки раз превышающие их собственные размеры. Средний размер диаметров газовых молекул обычно равняется 10-8 ...10-7 см. При атмосферном давлении в одном кубическом сантиметре газа находится 2,7 1019молекул. Скорости полета газовых молекул лежат в интервале от 0 до 108 см/с.. Наиболее вероятная скорость их полета составляет и =4*104 см/с.. Одна молекула совершает до 1012 столкновений в секунду с другими молекулами при средней длине свободного пробега lO-8.-.lO-7 см.. При столь высоких скоростях движения газовые молекулы имеют кинетическую энергию во много раз превышающую энергию взаимодействия (притяжения) между этими же молекулами на близких расстояниях (рис.1.11), поэтому в своей основе силами взаимодействия между молекулами являются силы отталкивания.
>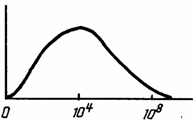
Рис. 1.11. Распределение газовых молекул по скоростям.
Особенностью строения газа и высокой подвижностью их молекул можно объяснить многие встречающиеся на практике явления (например, быстрое заполнение газом пустых сосудов, быстрое распространение газовых молекул, высокую сжимаемость газов, быстрое окисление пищевых продуктов и др.).
Основные газовые законы. Для описания свойств 1 киломоля реального газа используют уравнение Ван-дер-Ваальса
( p +pизб)(V – b) =RJ,(1.2.)
гдe р — давление газа; ризб = a/V02 — избыточное давление молекул газа, возникающее при приближении молекул газа к препятствию на растояние менее чем 10-7 см, когда начинают действовать между ними силы притяжения; V и V0 — объем газа; b — запретный объем газовых молекул, включающий в себя как собственный объем молекул, так и объем, прилегающий к ним, который они занять не могут.
При этом полная энергия газа равняется
Е = Екин + Епот,(1.3.)
где Екин = сvJ - кинетическая энергия реального газа; Епот = a/V —потенциальная энергия реального газа; cv — теплоемкость газа при постоянном объеме; J — температура; а — постоянная, зависящая от сорта газовых молекул; V — объем.
Это выражение позволяет определить эффект Джоуля-Томсона, заключающийся в изменении температуры газа при его расширении в условиях отсутствия теплообмена и совершения внешней работы
cvmдж =- -a/V2,(1.4.)
гдe mдж = dJ — коэффициент Джоуля.
В зависимости от природы межмолекулярного взаимодействия он может быть положительным в условиях, когда между молекулами газа превалируют силы отталкивания, и отрицательным, когда превалируют силы притяжения.
Очень часто для описания свойств разреженных и разогретых газов или в расчетах, не требующих высокой точности, используется основное уравнение кинетической теории газов (уравнение Клаузиуса), устанавливающее связь между давлением газа р, концентрацией молекул в единице объема п и энергией Екин
р = (2/3) n.Екин(1.5.)
Следствием его является
Екин = (3/2) kJ,(1.6.)
из которого следует, что средняя кинетическая энергия движения молекул идеального газа, пропорциональна абсолютной температуре, и зависит только от нее. Тем самым температура становится количественной мерой энергии теплового движения молекул, из которых состоит газ. Поэтому, при одинаковой температуре средняя кинетическая энергия всех газов одинакова, несмотря на различие масс молекул.
Явление переноса. Двигаясь хаотично, молекулы газа переходят из одних точек пространства в другие, перенося присущую им массу, энергию и количество движения. Явления (процессы), объединенные сходством закономерностей, связанных с движением молекул, получили название явления переноса.
Диффузия — явление, связанное с постепенным распроспранением в газе массы примесных молекул. Оно характеризуется выражением
j= -D(Dn/Dx)(1.7.)
или поток молекул примеси j, диффундирующих через единицу площади за единицу времени, прямо пропорционален градиенту концентрации Dn/Dх = (n2-n1)/(2l) (здесь n1 и n2; — концентрация примесных молекул на расстоянии удвоенной длины среднего пробега молекул). Коэффициент диффузии D — численно равен потоку молекул, проходящих через единицу площади за единицу времени при градиенте концентрации, равном единице. Знак минус в этом уравнении указывает на направление примесных молекул в сторону уменьшения их концентрации.
Вязкость газа (внутреннее трение молекул при ламинарном течении) связана с сопротивлением относительному смещению слоев газа (жидкости). Оно обуславливается переносом молекулами от слоя к слою количества их движения. Это явление наблюдается, например, при плоскопараллельном относительном смещении гладких твёрдых тел, удаленных друг от друга на некоторое расстояние в среде газа (жидкости). В этом случае закон И.Ньютона (1687 г.) гласит
Fтр = -hт(Dv/Dx) (1.7.) или
сила внутреннего трения Fтр, возникающая в газе, прямо пропорциональна коэффициенту внутреннего трения или динамической вязкости системы hт и градиенту скорости Dv/Dx. Знак минус указывает на то, что сила трения направлена в обратную сторону смещения слоев газа (жидкости).
Теплопроводность — явление, связанное с передачей энергии от более нагретых к менее нагретым молекулам. Здесь осуществляется передача энергии молекулами от слоя к слою
q = - lт(DJ/Dх) (1.8.) или
поток тепла, проходящий через единицу площади в единицу времени, прямо пропорционален коэффициенту теплопроводности -lт и градиенту температуры DJ/Dх. Знак минус указывает на то, что тепло распространяется от более нагретого к менее нагретому слою газовых молекул.
Теплоемкость газовых молекул (кДж/кмоль-градус) определяется приращением количества тепла dQ, необходимого системе для повышения ее температуры на один градус (dJ).
cv=dQ/dJ.(1.9.)
На величину теплоемкости газовых молекул оказывает влияние их количество поступательного и вращательного движения i
cv = iR/2.(1.10.)
где R — универсальная газовая постоянная.
Между теплоемкостью идеального газа при постоянном объеме cv и теплоемкостью при постоянном давлении cр уравнение Майера устанавливает связь вида
ср=cv+R или ср = (i+2)R/2.(1.11)
В этом случае коэффициент Пуассона g
g = сp/сv = (i+2)/i.(1.12)
Численные значения этих величин приведены в табл. 1 2
Степени свободы, удельные теплоемкости и коэффициент Пуассона для одноатомных и многоатомных молекул
| Строение молекулы | i | cv | cp | g |
| Одноатомные | 3 | 12,5 | 20,81 | 1,67 |
| Двухатомные | 5 | 20,8 | 29,11 | 1,4 |
| Трехатомные | 6 | 25,0 | 32,31 | 1,33 |
1.2.7. Жидкости. К жидкостям относятся вещества, способные сохранять свой объем, принимая форму сосуда, в котором они находятся, обладающие очень малой сжимаемостью и способные сопротивляться растяжению.
Жидкости занимают промежуточное положение между реальными газами и твердыми телами. Молекулы в них располагаются по отношению друг к другу ближе, чем в газах, и благодаря этому наблюдается большее взаимодействие (притяжение) между ними.
Вязкость и диффузия в жидкостях. Плотность жидкости в 1000 раз выше плотности газа. Это сказывается и на явлениях переноса в жидкостях. Так, диффузионные процессы протекают в жидкостях значительно медленнее, чем в газах, а вязкость (внутреннее трение) жидкостей значительно выше.
Полная внутренняя энергия молекул жидкости складывается из потенциальной энергии, обусловленной молекулярным взаимодействием, и кинетической, зависящей от температуры нагрева жидкости. Эти составляющие энергии молекул жидкости близки друг другу по величине. Это определяет многие свойства жидкости и существенно осложняет создание единой теории строения жидкостей.
Из большого числа имеющихся теорий наибольшее распространение получила дырочная теория жидкого состояния вещества, разработанная Я.И.Френкелем. В то же время экспериментально установлено, что область существования вещества в жидком состоянии ограничена как высокими температурами, при которых возможен переход вещества в газообразное состояние, так и низкими, обуславливающими переход жидкости в твердое состояние посредством кристаллизации. Ближайшие соседи каждой молекулы жидкости располагаются друг относительно друга, образуя определенную структуру вещества, получившего название близкого порядка. Однако, уже на удалении трех-четырех молекулярных диаметров сходство в упаковке частиц друг относительно друга нарушается С повышением температуры упорядоченность в расположении соседних молекул постепенно уменьшается и их расположение становится все более и более хаотическим.
Очень важной для решения ряда технических задач является зависимость вязкости жидкости от температуры
hж = АеW/kJ,(1.13)
где А— множитель, характерный для определенной жидкости, в малой степени зависящий от температуры J; W — энергия активации, необходимая для перемещения молекулы из одного положения в другое; k — постоянная Больцмана.
Данные расчета по этой формуле хорошо совпадают с экспериментальными. Вместе с тем, они показывают, что механизмы внутреннего трения в жидкостях и газах различны. В жидкостях вязкость с повышением температуры падает, а в газах — растет пропорционально J. Причина различия в том, что в газах вязкость определяется скоростью хаотического теплового движения молекул, а в жидкостях —подвижностью молекул, во многом зависящей от действия молекулярных сил.
В газах, ввиду наличия одинакового механизма переноса массы и количества движения между молекулами, коэффициенты диффузии Dг и вязкости hт прямопропорциональны друг другу, т.е.
DГ » hж.(1.14)
В жидкостях, ввиду специфики их строения и взаимодействия между молекулами, коэффициенты диффузии Dж и_вязкости hж являются обратнопропорциональными, т.е.
Dж » 1/hж.(1.15)
Поверхностное натяжение жидкости. Молекулы жидкости вблизи поверхности испытывают притяжение со стороны своих соседей Внутри жидкости и вдоль поверхности. тем самым появляются силы поверхностного натяжения и силы, стремящиеся втянуть молекулы из поверхностного слоя внутрь жидкости. Эти силы, в сочетани с хорошей подвижностью ее молекул, стремятся придать определённому объему свободной жидкости форму с минимумом поверхности.
Для оценки сил поверхностного натяжения жидкости используется коэффициент поверхностного натяжения а, который представляет собой отношение внешней силы Fв, приложенной к линейному размеру l, к поверхности жидкости
а = Fв/l.(1.16)
Можно представить еще коэффициент поверхностного натяжения жидкости как избыточную свободную энергию DЕпов приходящуюся на единицу ее поверхности DА, т.е.
а = DЕпов/DА.
1.3. Влияние среды на исходное состояние поверхностей пищевых материалов
Заметные изменения в поверхностных слоях пищевых материалов, в результате их взаимодействия с окружающей средой (воздухом и водяными порами), могут происходить, например, при консервировании методом сушки и сублимации, а также, при увлажнении. Эти процессы связаны с механизмами сорбции, смачивания, капиллярными явлениями, химическим взаимодействием.
1.3.1 Сорбционные процессы. Производство и хранение пищевых материалов производится в среде, содержащей , воду, воздух и жировые вещества, которые в совокупности и в отдельности представляют. собой отнюдь не однородную систему.
Воздух помимо смеси газовых молекул содержит дымы и туманы. Эти примеси газа, с размерами частиц менее 1 мкм образуют аэрозоли. В результате взаимного трения эти частицы часто несут на себе положительные и отрицательные заряды, которые взаимодействуют с поверхностью.
Жидкости, содержащие в себе во взвешенном состоянии твердые частицы, называются суспензиями,а содержащие несмешивающиеся с основной мелкие капельки другой жидкости — эмульсиями. Вместе эти жидкости получили название гидрозоли, и подробно они будут рассмотрены в третьей главе.
Кроме того, в жидкостях и газах могут находиться и молекулы поверхностно-активных веществ (ПАВ). К ним относятся, например, органические вещества, имеющие полярные группы ОН, СООН, и NH2, хорошо растворимые в воде, и неполярные группы — состоящие из углеводородные цепей типа СН2— не смачивающиеся водой (рис. 1.12). Примером жидкости, содержащей гидрозоли и ПАВ, являются маргарины, майонезы, коктейли, некоторые кремы.
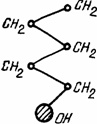
Рис 1.12 Структурная схема молекулы поверхностно-активного вещества.
Наличие нескомпенсированных молекулярных связей на границе раздела фаз, а также и внутри материала, создает условия для поглощения твердыми и жидкими телами молекул и частиц из прилегающих к ним сред (газов и жидкостей). В общем случае процесс поглощения инородных атомов и молекул жидкими и твердыми веществами получил название сорбции]. Она включает в себя процесс адсорбции — случай, когда процесс происходит на границе раздела фаз (таких как, например, твердое тело — газ, твердое тело — жидкость и жидкость — газ). Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощенное из прилегающего объема вещество - адсорбатом. Молекулы адсорбата, приближаясь из объема газа или раствора к поверхности раздела фаз, испытывают притяжение со стороны этой поверхности. При соприкосновении с нею притяжение приближающихся молекул уравновешивается силами отталкивания, возникающими между молекулами и частицами, составляющими раздел фаз. Таким образом поверхность адсорбента постепенно покрывается адсорбционным слоем молекул адсорбата. Пропорционально заполнению молекулами адсорбата поверхности адсорбента и уменьшению ее свободной поверхностной энергии выделяется теплота адсорбции. Она зависит от природы и строения молекул адсорбата и их ориентации у поверхности, а также от природы и структуры самой поверхности.
Процесс, обратный адсорбции, получил название десорбции. И для его проведения требуется подведение извне энергии пропорциональной теплоте адсорбции.
Различают два вида адсорбции: физическую — обратимую, обусловленную действием относительно слабых Ван-дер-Ваальсовых сил, и хемосорбцию — необратимую и обусловленную проявлением достаточно больших по величине химических связей (валентных сил). Теплота физической адсорбции бывает близкой к 1...24 кДж/моль для простых молекул и 40...80 кДж/моль — для больших молекул. При хемосорбции она составляет 40...400 кДж/моль.
Поверхность имеет разную по величине удельную поверхностную энергию твердого тела (гетерогенную) и поэтому не все ее участки обладают одинаковыми адсорбционными свойствами. Кроме того различные микродефекты поверхности обладают и значительно большей способностью к адсорбированию, чем гладкие участки. Их называют обычно активными центрами. Судить об интегральном заполнении поверхности молекулами адсорбата позволяют изотермы адсорбции — представставляющие графическое выражение зависимости количества адсорбированных молекул на плоской поверхности твёрдого тела от равновесного давления газа (или равномерной концентрации раствора) при постоянной температуре. В зависимости от интенсивности силового поля на поверхности адсорбента и при различных внешних условиях могут образовываться адсорбционные слои в одну (мономолекулярная адсорбция), две или несколько молекул (полимолекулярная адсорбция). Простейшим уравнением изотермы мономолекулярной адсорбции является уравнение Ленгмюра для адсорбции на однородной поверхности
qа=kp/(1 + kp); p=qа /[k(1 - qа),(1.18)
где q =а/аm, — степень заполнения поверхности (аm — предельная величина адсорбции в плотном монослое); р — давление абсорбата; k — константа равновесия взаимодействия адсорбат — адсорбент, во многом зависящая от свойств и состояния поверхности адсорбента (например, свободной поверхностной энергии, характеризующейся углом смачивания ее адсорбатом).
Адсорбционный процесс на поверхности раздела происходит с очень большой скоростью, измеряемой долями секунды, и только в пористых телах он завершается за 1 мин. Хемосорбция же определяется как скоростью протекания химической реакции, так и диффузией вещества через окисленный слой, поэтому скорость процесса хемосорбции колеблется в очень широких пределах. В ряде случаев о количестве адсорбированного вещества судят и по массе адсорбата, отнесенной к единице поверхности адсорбента.
При контактировании твердых пористых тел необходимо часто учитывать количество влаги, которое сконденсировано в этих порах. Для этого используется обычно уравнение Дубинина-Радушкевича, которое имеет такой вид
а = а0 ехр -[ RJ ln(Ps/Pg) / kА] (1.19)
где а — адсорбция; а0 — предельная величина адсорбции; R — универсальная газовая постоянная; J — температура в градусах Кельвина: рs — давление насыщенных паров адсорбата; рg -парциальное давление адсорбата; k — коэффициент аффинности; V — мольный объем жидкого адсорбата
k = V/Vбен и = А=12/х, где Vбeн — мольный объем жидкого бензола; х — полуширина поры.
Для твердых тел (жидкостей) свойственна и внутренняя сорбция (атомов, ионов, молекул), протекающая на внутренних поверхностях твердых тел (на границах зерен и дефектах его структуры, обладающих свободной поверхностной энергией) и т.п. Возможен процесс внутреннего поглощения веществ в газах, жидкостях и твердых телах (абсорбция). Жидкость или твердое тело, поглощающее газ или растворенное вещество называют абсорбатом. Этот процесс обуславливается как диффузией абсорбатов в абсорбентах, так и процессами их растворения. Порой поглощение абсорбата может осложняться и протекающими хемосорбционными процессами в самом абсорбенте.
1.3.2. Угол смачивания и капиллярные явления. О характере смачивания твердых поверхностей чаще вето судят по углу смачивания, который (рис.1.13) определяется как результат сложения векторов сил поверхностного натяжения на границах раздела фаз твердое тело— жидкость s12, жидкость—газ s23 и твёрдое тело—газ s13- В случае сложения этих вектров, когда их результирующая становится равна нулю, система приобретает устойчивое положение. Угол смачивания q в этом случае определяется как угол между касательной к поверхности жидкости в точке касания ее с твердым телом и поверхностью твердого тела, проведенной через слой жидкости. При q < p/2 считается (рис. 1.14), что поверхность твердого тела гидрофильная (хорошо смачивается жидкостью), а при углах q > p/2 — поверхность гидрофобная (плохо смачивается жидкостью). Угол q является очень чувствительным к свойствам и состоянию поверхности как твердого тела так и жидкости. Например, по углу смачивания чистой водой поверхности твердого тела можно с большой достоверностью судить о процессах, происходящих на поверхности твердого тела (например, степени ее окисления, загрязненности и т.п.).
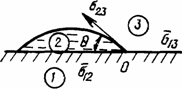
Рис 1.13 Схема действующих сил поверхностного натяжения на границе раздела фаз
1-твердое тело, 2 -жидкость, 3- газ
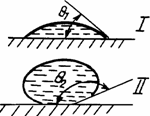
Рис 1.14 Характер смачивания жидкостью поверхности твердого тела 1—в случае хорошего смачивания, II — в случае плохого смачивания.
Угол смачивания жидкостью поверхности твердого тела во многом определяет и процессы, происходящие в капиллярах. При малых углах смачивания в капиллярах (с гидрофильной поверхностью) образуются вогнутые мениски, под которыми в жидкости (рис. 1.15) создается отрицательное избыточное давление (разряжение) равное
Dp = 2L/RМ,(1.20)
где L — коэффициент поверхностного натяжения; RМ— радиус кривизны мениска.
Это отрицательное давление приводит к подъему столба жидкости массою pgh и им уравновешивается, т.е.
2L/RМ=pgh1,(1.21)
где р — плотность жидкости; g — ускорение силы тяжести; h1 высота подъема жидкости. Из этого равенства следует, что высота подъема столба жидкости определяется выражением вида
h1 = 2L/(.Rpg) или h1 = 2Lcosq1/(Rpg).(1.22)
Это означает, что с увеличением коэффициента поверхностного натяжения и уменьшением радиуса капилляра, плотности жидкости и угла смачивания высота подъема столба жидкости возрастает. Наблюдается и обратный эффект. Этот факт изменения степени подъема жидкости широко используется для пропитки пористых пищевых материалов. Также широко встречается в природе при подъеме жидкости по капиллярам растений и т.п.
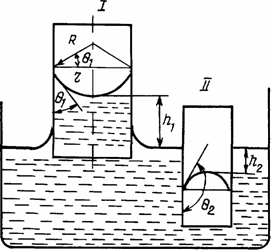
Рис 1.15 Капиллярные эффекты в цилиндрических капиллярах, по разному смачивающихся жидкостью:
I — внутренняя поверхность трубки гидрофильна, II — внутреняя поверхность трубки гидрофобна.
Аналогичным же образом можно показать, что при гидрофобных внутренних поверхностях капилляров мениск жидкости будет создавать избыточное положительное давление, и на эту величину столб жидкости в капилляре окажется ниже уровня поверхности жидкости в суде на высоту, равную h2 (см. рис. 1.15). Этот эффект широко используется в случаях, например, когда необходимо создать пористую преграду; препятствующую прохождению жидкости, или ткань, отталкивающую воду.
Изогнутые мениски жидкости оказывают большое влияние и на характер взаимодействия между напылёнными ( например, нанесёнными на поверхность мелкими частицами панировочного слоя и слоя глазури) и такими же частицами, лежащими на поверхностях твердых тел, достигая сжимаемыx усилий между частицами эквивалентных давлению 20 атмосфер и более (рис.1.16) Например, на одном и том же месте напыленной поверхности, только за счет образования мономолекулярных, полимолекулярных слоев и манжет жидкости в местах контакта частиц коэффициент трения между напыленными телами может резко меняться. А сам поверхностный слой твердых мелких частиц только от количества находящейся в нем влаги может менять свои свойства от характерных для твердых тел, минуя свойства пастообразных, и вплоть до жидкости (сильно разбавленных коллоидных растворов).
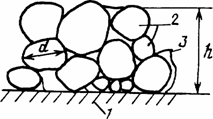
Рис 1 16 Модель поверхностного слоя напыленных твердых тел
1 — твердое тело, 3 — напылённые частицы 3 — мениски жидкости (адсорбированной из воздуха); h — приведенная толщина слоя в 10 20 мкм, d — средний диаметр частиц близкий к долям микрона.
1.3.3. Химические и физические механизмы воздействия на поверхностные слои твердых тел.
Химические механизмы Часто состояние поверхности материалов находящихся в кристалическом состоянии термодинамически является неустойчивым и постепенно стремиться перейти в более устойчивое аморфное (ионное) состояние. Этому процессу способствуют адсорбированные молекулы газов и паров, а также оседающие на них аэрозольные частицы. Все вместе приводит к концентрации прежде всего на наиболее активных участках поверхностей твердых тел молекул кислорода, воды, растворов элекролитов, твердых частиц и поверхностно-активных веществ. Тем самым на границе раздела фаз, материал — окружающая среда (чаще всего сконденсированная жидкость или газ) создаются условия для возникновения химических процессов, приводящих к разрушению химически активных веществ пищевых материалов и к разрушению всего вещества в процессе окисления.
По механизму процесс окисления делят на химический и электрохимический.
Химический тип окисления и восстановления окислительного компонента среды происходит в одном акте. В этом случае, окислитель, например, адсорбированный атом кислорода О(адс), отнимает у материала, находящегося в твердом состоянии Ме(Т), валентные электроны и одновременно вступает с ним химическое взаимодействие типа
mМe(T) + (mn/2)0(адс) =mМеn+ +(mn/2)02- = МеmОmn/2(Т).(1.23)
В результате этого на поверхности образуется слой нового материала (чаще всего окисла), который обычно значительно отличается от свойств исходного материала.
Электрохимический тип окисления обуславливается переносом ионов под действием электрохимического поля, источником которого могут быть как внешние поля, так и контактная разность потенциалов, имеющаяся на поверхности твердого тела, обусловленная, например, включением инородных атомов и аномалиями в строении структуры основного материала. Непременным условием для этого типа окисления должна быть и электропроводящая среда (например, образующаяся из сконденсированной влаги и осевших в нее аэрозолей и гидрозолей из окружающей среды).
Химическое воздействие пищевых материалов с окружающей средой приводит к изменению их химического состава структуры и агрегатного состояния, и как следствие, к изменению физико-механических свойств. С этим необходимо считаться при проектировании технологических процессов и рабочих органов.
Физические механизмы. Адсорбционные слои ПАВ, например, на поверхности жидкости, приводят к тому, что поверхностный слой жидкости покрывается молекулами других веществ, которые обладают и своей поверхностной энергией и поверхностным натяжением (рис. 1.17). Тем самым небольшое количество ПАВ оказывается способным резко воздействовать и на свойство жидкости.
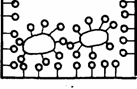
Рис 1.17. Схема взаимодействия поверхности жидкости, частиц гидрозолей и моющий эффект за счет введения молекул ПАВ.
С другой стороны, находящиеся в объеме жидкости молекулы ПАВ активно высаживаются на поверхность сосуда, где находится жидкость, и на поверхности гидрозолей. Высаживаясь на поверхности частиц и стенки сосуда, они образуют на них электрические поля одного знака. А это означает, что частицы, электрические поля которых взаимодействовали со стенками сосуда и благодаря этому к ним притягивались, после появления на их поверхности молекул ПАВ стали отталкиваться друг от друга. На этом принципе, например, основан и эффект моющего действия молекул ПАВ, а также эффект стабилизации гидрозолей, за счет появления сил, препятствующих их слипанию (коагуляции) и выпадению в осадок (явление седиментации).
ПАВ адсорбированные на поверхность твердого тела оказываются способными существенно менять характер их смачивания жидкостью (рис. 1.18), гидрофилируя или гидрофобируя ее. Здесь обращается внимание на то, что для достижения желаемого эффекта необходимо тщательно подбирать к свойствам подложки и жидкости определенные ПАВ с характерными для них свойствами. Используя их, можно направленно управлять капиллярными эффектами, фильтрацией веществ и др.
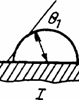
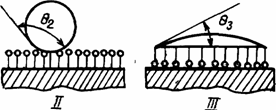
Рис. 1.18. Изменение характера смачивания поверхности твердого тела в зависимости от выбранного ПАВ, определяющего ее состояния:
I — исходная поверхность; II — гидрофобная поверхность; III — гидрофильная поверхность; q3 < q1 < q2;
Особое место среди физических методов воздействия на свойства взаимодействующих тел занимает адсорбционное понижение прочности твердых тел, получившее название эффект П.А. Ребиндера. В основе его лежит понижение свободной поверхностной энергии s, как на внешней поверхности твердого тела, так и на внутренних поверхностях, возникающих и развивающихся в процессе деформации по дефектам структуры или в результате скопления дислокации. А понижение прочности, вызванное уменьшением величины s на внешней поверхности тела, образует обширную группу явлений, связанных с пластифицированием твердого тела в процессе его деформации,. со снижением его предела текучести.
1.3.4. Физические процессы адгезии и когезии пищевых материалов. Наличие нескомпенсированных молекулярных сил на границе раздела фаз – твердое тело-газ, твердое тело-жидкость, жидкость-газ - образует появление дополнительных сил притяжения (прилипания) между соприкасающимися телами. Образование молекулярной связи между поверхностями соприкасающихся с разнородными твердыми или жидкими телами (фазами) получило название адгези. Обычно об уровне адгезии судят по силе отрыва одного тела от другого или по удельной адгезии - представляющей отношение силы отрыва к площади отрыва (адгезионного шва).
Термодинамической характеристикой адгезии является убыль свободной энергии на 1 см поверхности адгезионного шва в изотермическом обратимом процессе. Работа адгезии Wa (т.е. работа обратимого адгезионного отрыва) равняется
Wа = s10 + s20 + sl2 (1.24)
Где s12 - поверхностное натяжение на границе фаз 1 и. 2, между которыми реализуется адгезионное взаимодействие; s10 и s20, поверхностное натяжение каждой из фаз 1 и 2 и окружающей средой (воздухом).
Адгезия весьма чувствительна к малейшим изменениям свободной поверхностной энергии контактирующих тел. Например, за счёт образующихся слоев ПАВ, всевозможных нанесённых поверхностных слоёв, загрязнений и т.п.
Адгезия твердых тел в атмосферных условиях обычно бывает небольшой, поскольку площадь истинного контакта и участков поверхности, находящейся в поле действия молекулярных сил, бывают незначительными, и те оказываются покрытыми адсорбционными слоями. Предельные значения адгезии наблюдаются при |контакте с жидкой фазой, когда площадь истинного контактирования тел существенно увеличивается и десорбируются ранее находящиеся там поверхностные слои. Предельная адгезия возникает также при соприкосновении ювенильно чистых твердых тел в пластическом и эластичном состоянии, а также при образовании новой твердой фазы на поверхностях контактирующих тел.
Если соприкасающиеся тела одинаковы, адгезия при полном их соприкосновении переходит в когезию (сцепление). Когезия характеризует прочность тел - их силу сцепления между молекулами, атомами или ионами вещества в данном теле. Она во многом отражает особенность строения конкретного тела. По характеру разлома щва между телами часто судят о характере молекулярного взаимодействия, существовавшего между ними. Если разрыв происходит по границе раздела между телами - то это была адгезионная связь. Если же разрыв происходит по объему одного из тел - это разрыв когезионной связи. Это наблюдается в условиях, когда адгезионная связь оказывается прочнее когезионной связи более слабого материала.
Процессы адгизии широко используется в пищевых производствах, при формировании изделий и нанесении поверхностных слоёв,способствуют процессам замеса, перемещения тестообразных материалов в шнековых рабочих органах, и др.. Вопросам адгезии, также уделялось внимание и в первой части пособия при рассмотрении свойств упруго-вязко-пластичных материалов.