Раздел IV.
МЕТАЛЛУРГИЧЕСКИЕ ОСНОВЫ СВАРКИ ПЛАВЛЕНИЕМ
НАЗАД: 4.3. Шлаковая фаза при сварке плавлением
4.4. Окисление металла при сварке
Окисление металла при
сварке возможно в результате его взаимодействия как с газовой, так и со
шлаковой фазами.
Окисление газовой фазой
возможно, если в ней содержатся молекулярные газы, способные при диссоциаци
выделять кислород (например, СО2 или пары воды). Окисление газовой
фазой возможно, если парциальное давление кислорода превышает упругость диссоциации
окисла, т.е. выполняется условие:
![]()
Возможность окисления
свободных элементов при различных способах сварки можно проанализировать по
рис. 49.
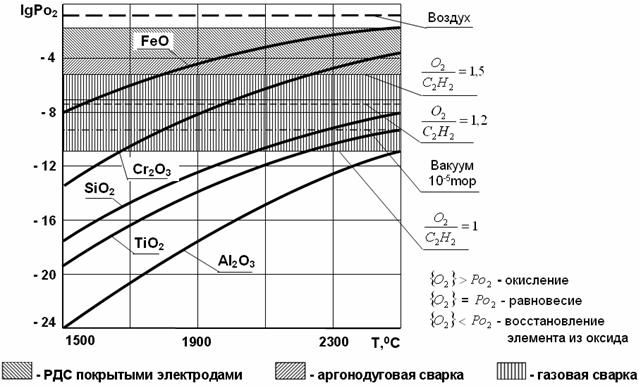
Рис. 49. Зависимость упругости диссоциации свободных
оксидов (Ро2 в атм.) от температуры
При сварке на воздухе без
защиты зоны плавления парциальное давление кислорода во всем диапазоне
температур, имеющих место в зоне плавления, превышает упругость диссоциации
окислов всех элементов, приведенных на рис. 49. Следовательно, будут окисляться
все элементы, прежде всего преобладающий элемент сплава. При газовой сварке
нормальным пламенем и в вакууме железо не должно окисляться. Все легирующие
элементы сталей будут в той или иной степени окисляться при любом способе
сварки, но степень их окисления будут гораздо меньше, чем при сварке на
воздухе.
Окисление металла шлаковой
фазой возможно в трех случаях:
-
при наличии на
свариваемых кромках оксидов, способных при взаимодействии с жидким металлом
окислять его;
-
при содержании в
шлаке оксидов, растворимых в металлической фазе;
-
при использовании
для сварки химически активных шлаков, вступающих в обменные реакции с металлом
сварочной ванны.
Рассмотрим данные случаи.
При сварке металлов,
растворяющих кислород, сварочная ванна может окисляться за счет окалины и
ржавчины, находящихся на свариваемых кромках. У сталей формула ржавчины
mFe3O4×(H2O)p + nFe2O3×(H2O)q.
В этом случае высшие оксиды
будут раскисляться железом с образованием FeO:
Fe3O4 + Fe = 4 FeO; (4.21)
Fe2O3 + Fe = 3 FeO; (4.22)
Образовавшаяся закись
железа FeO частично
растворяется в расплавленном металле, а другая часть – в шлаке.
Если оксид, растворимый в
металле, находится в шлаке, то в соответствии с законом распределения между
концентрацией оксида в металле [MeO] и в шлаке
(МеО) в состоянии равновесия устанавливается соотношение:
![]() , (4.23)
, (4.23)
где L – константа распределения
вещества в двух несмешивающихся растворителях.
Величина этой константы
зависит от растворителя и растворяемого вещества, а также от температуры.
При относительно низкой
концентрации оксида железа в металле и высокой его концентрации в шлаке
возможен переход оксида из шлака в металл. Это тем более вероятно, что при
повышении температуры растворимость FeO в
стали и степень диссоциации шлаков увеличивается.
Ерохин А.А., обобщив
экспериментальные данные разных авторов, получил следующую зависимость между
содержанием кислорода в металле и закиси железа в шлаке [15]:
|
(FeO), % |
14,2 |
15,0 |
22,7 |
26,8 |
56,0 |
61,0 |
|
[О], % |
0,036 |
0,039 |
0,062 |
0,118 |
0,187 |
0,211 |
При температуре 1650 0С
константа распределения, выраженная через отношение концентрации закиси железа
в шлаке к концентрации кислорода в металле, ![]() составляет
400 для кислых и 250 для основных шлаков. Если принять максимально допустимое
содержание кислорода в стали 0,04 % (как в кипящих сталях), то содержание
закиси железа в кислом шлаке не должно превышать
составляет
400 для кислых и 250 для основных шлаков. Если принять максимально допустимое
содержание кислорода в стали 0,04 % (как в кипящих сталях), то содержание
закиси железа в кислом шлаке не должно превышать
(FeO)max = L×[O]max =
400×0,04 = 16 %.
Для основного шлака эта
величина не должна превышать 10 %.
Окисление металла активными
шлаками происходит в связи с обменными реакциями. Примерами таких реакций
служат кремне- и марганцевосстановительные процессы, происходящие при сварке
сталей с использованием активных кремне-марганцовистых флюсов:
![]() (4.24)
(4.24)
![]() (4.25)
(4.25)
При высокой температуре
реакции идут вправо. Закись железа, являясь продуктом этих реакций, распределяется
между шлаком и металлом в соответствии с константой распределения. В шлаке
закись железа сразу связывается в комплексные соединения (силикаты, титанаты),
нерастворимые в металле.
Реакции, протекающие вправо
в передней части сварочной ванны, следует рассматривать как бы протекающие в
два этапа. При возрастании температуры сродство элементов к кислороду
уменьшается, происходит частичная диссоциация оксидов. Образовавшийся кислород
реагирует с преобладающим элементом сплава – с железом. Кремний и марганец
переходят в металлическую фазу – в сварочную ванну.
При охлаждении (в хвостовой
части сварочной ванны) сродство элементов к кислороду растет. Кремний и
марганец начинают раскислять сталь, но при этом они взаимодействуют лишь с той
частью закиси железа, которая осталась в металле.
В металле шва получим
некоторое приращение кремния и марганца по сравнению с их исходным содержанием
в свариваемом металле.
Так как процесс
кристаллизации сварочной ванны протекает очень быстро, то часть эндогенных
(внутриобразованных) оксидных включений (SiO2 и MnO) не успевают выделиться из металла шва.
Приращение содержания
кислорода в металле шва определится уравнением:
![]() (4.26)
(4.26)
где D[Si] и D[Mn] – приращение
кремния и марганца в металле шва в результате протекания кремне- и
марганцевосстановительных процессов (%).
Например, если D[Si] = 0,2 %, а D[Mn] = 0,5 %, то
+D[О] = 0,044 %.
Увеличение содержания
кислорода ухудшит прежде всего ударную вязкость металла.
В случае наличия в
свариваемом металле элементов с большим сродством к кислороду окисление их
двуокисью кремния или закисью марганца может быть очень интенсивным. Например,
при сварке легированных сталей, содержащих 15 ¸ 18 % Cr, потери Cr на окисление в результате реакций с (SiO2) и (MnO) при концентрации последних в шлаке 10 ¸ 20 % могут составить несколько процентов.
Алюминий и титан,
находящиеся в легированных сталях (при большом содержании SiO2 и MnO в шлаке), при сварке могут выгореть почти полностью.
Поэтому высоколегированные стали рекомендуют сваривать с применением
бескислородных или пассивных флюсов.
ДАЛЕЕ: 4.5. Раскисление
металла при сварке