Раздел IV.
МЕТАЛЛУРГИЧЕСКИЕ ОСНОВЫ СВАРКИ ПЛАВЛЕНИЕМ
НАЗАД: 4.6. Легирование металла шва при сварке плавлением
4.7. Рафинирование металла шва при сварке плавлением
Рафинирование (фр. raffiner – очищать) – это очистка
от посторонних примесей какого-либо технического продукта. При сварке сталей
это удаление из металла шва вредных примесей – серы S и фосфора P.
В чем выражаются
отрицательные свойства этих элементов? Рассмотрим, прежде всего, влияние серы
на свойства сталей.
Максимальная растворимость
серы в сталях – 0,02 %. Превышающая это количество сера будет находиться в
сталях в виде химических соединений. Прежде всего это сульфид железа FeS. Опасность FeS
усугубляется тем, что он способен растворяться как в металле, так и в шлаке.
При этом, если его растворимость в шлаке достигает 2 %, то в металле его
предельная растворимость – (5 ¸ 7) %. Сульфид железа FeS имеет температуру плавления 1195 0С (по
другим сведениям 1183 0С), что значительно ниже температуры
плавления сталей. Кроме того, сульфид железа образует двойные эвтектики FeS + Fe с Тпл
= 985 0С и 2FeО × SiO2 + FeS c Тпл = 980 0С. Возможно образование
тройной эвтектики Fe + FeS + MnS с Тпл
= 980 0С. В легированных сталях может быть образован сульфид никеля
с температурой плавления около 800 0С или эвтектика Ni3S2 + Ni с
температурой плавления 645 0С. При большом содержании серы в стали
образуется FeS2.
Обычно сернистая эвтектика Fe + FeS
располагается по границам зерен (рис. 50,а). При нагреве около 1000 0С
происходит оплавление легкоплавкой и хрупкой эвтектики, образуются надрывы,
трещины, т.е. наблюдается красноломкость металла. В сварных соединениях это
приводит к горячим (кристаллизационым) трещинам.
Кроме того, увеличение
содержания серы в сталях на 0,01 % повышает температурный порог хладноломкости
стали на 10 0С.
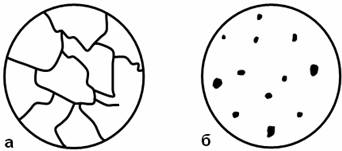
Рис.50. Схема расположения сернистых включений на
нетравлённом шлифе:
а – сернистая эвтектика Fe + FeS; б – сульфид
марганца MnS
С увеличением содержания
углерода в сталях усиливается вредное воздействие серы на свойства металла, так
как углерод способствует ликвации серы.
Опасная концентрация серы в
сталях – более 0,05 %. Поэтому по стандартам содержание серы в углеродистых
сталях ограничивают до 0,04 %, в легированных – до 0,02 ¸ 0,03 %. Лишь в стальных отливках содержание серы
ограничивается величиной 0,05 %.
Поскольку металлическая
фаза (основной и присадочный металл) содержат серы до 0,05 %, то нет
необходимости рафинирования при сварке в защитных газах. Такая потребность
возникает, если имеется шлаковая фаза. В шлаке сера и фосфор – неизбежные примеси
исходных компонентов. Например, гранит, входящий в состав электродных покрытий,
содержит до 0,1 % серы, столько же серы и в плавиковом шпате CaF2,
содержащемся в большинстве электродных покрытий, флюсов. Ферросплавы, входящие
в состав керамических флюсов, шихты порошковой проволоки, содержат 0,1 ¸ 0,2 % серы и до 0,3 % фосфора. Коэффициент перехода
серы из шлака в металл – 0,3. Поэтому при наличии шлаковой фазы вполне возможно
насыщение металла шва до величин, вызывающих образование горячих трещин.
Для исключения вредного
влияния серы на свойства металла прежде всего ограничивают ее содержание в
сталях. При необходимости используют более чистые по сере и фосфору металлы,
например, высококачественные стали, стали, подвергнутые электрошлаковому или
другому переплаву, стали, полученные из руд путем прямого восстановления (сталь
марки 20ПВ содержит всего лишь от 0,002 до 0,015 % серы).
В низкоуглеродистой
сварочной проволоке содержание серы и фосфора следующее:
|
Марка проволоки |
Св-08 |
Св-08А |
Св-08АА |
|
S не более, % |
0,04 |
0,03 |
0,02 |
|
Р не более, % |
0,04 |
0,03 |
0,02 |
В сварочных флюсах,
предназначенных для сварки низкоуглеродистых сталей, ограничивают содержание S и Р до (0,10 ¸ 0,15) % каждого из элементов, а для флюсов, используемых
для сварки легированных сталей, этот предел ограничивается до (0,05 ¸ 0,08) %.
В ацетилене содержание
вредных примесей ограничивают в следующих пределах: РН3 £ 0,02 %, H2S £ 0,05 %.
Для удаления серы из
металла шва используют процессы связывания серы в комплексы, нерастворимые в
металле, а удаляемые в шлак. Прежде всего серу переводят из FeS в сульфид марганца MnS. Сульфид марганца MnS нерастворим в сталях, в металле будет находиться в
виде глобулей, обособленных включений (рис. 50,б), имеет температуру плавления
1610 0С, т.е. выше температуры плавления стали:
[FeS] + [Mn] ® (MnS) + [Fe]. (4.37)
Необходимое содержание марганца в сталях,
предотвращающее образование горячих трещин, зависит от содержания в них
углерода, кремния и серы (см. рис. 51). Из рисунка можно определить, что при
содержании [C + Si] = 0,5 % и [S] = 0,03
% необходимое количество марганца, предотвращающее появление горячих трещин в
металле шва, должно быть не менее 0,75 %.
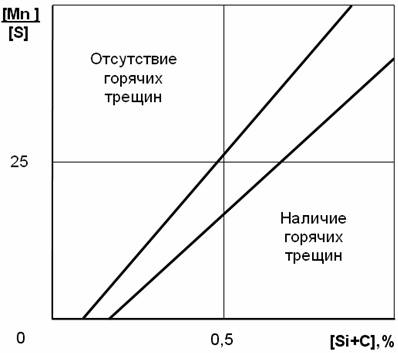
Рис.51. Влияние содержания С, Si и S на возможное появление
горячих трещин в металле шва
Одновременно с реакцией (4.37)
будет протекать процесс связывания серы путем ее взаимодействия с закисью
марганца:
[FeS] + (MnO) ® (MnS) + FeO. (4.38)
FeO частично останется в металле, а часть ее в
соответствии с законом Нернста уйдет в шлаковую фазу. Чем лучше раскисление стали,
тем активнее будет протекать реакция по уравнению (4.38).
Сродство элементов к сере
по мере его увеличения составляет следующий ряд:
Ni, Fe, Mn, Mo, Mg, Na, Ca, Al.
Поэтому более активно
рафинирует металл шва СаО:
(CaO) + [FeS] ® (CаS) + FeO. (4.39)
Следовательно, очистку
сталей от серы осуществляют основные окислы. Полезно действует плавиковый шпат CaF2,
переводя часть серы в летучее соединение SF6. Кроме
того, протекает следующая реакция:
2CaF2 + SiO2 + 2FeS = 2CaS + 2FeO + SiF4. (4.40)
Фосфор вызывает
охрупчивание металла. Как уже указано в разделе 4.2.2, совместное влияние
кислорода, серы и фосфора на ударную вязкость низколегированных сталей оценивается
уравнением (4.4):
KCV = 9,8 (28,8 – 120 [O] – 96 [S] – 86 [P]), Дж/см2.
В этих сталях не
допускается превышение эквивалента фосфора [Pэкв] свыше
0,08 %. Эквивалент фосфора определяется по уравнению (4.3):
[Pэкв] = [O] + 0,8[S] + 0,7[P], %
где O, S и Р – означают процентное содержание данных элементов
в стали.
Увеличение содержания фосфора
в сталях на 0,01 % повышает температуру порога хладноломкости металла на 20 0С.
Фосфор увеличивает размер
зерна. Как указано в разделе 3.7,
это ухудшает пластичность металла.
Снижение предела текучести
выражается уравнением (3.80):
![]()
где К и sо – const для данного материала;
d – диаметр зерна.
В сталях фосфор может
находиться в виде фосфидов Fe3P и Fe2P. Фосфиды также как и сульфиды способствуют
образованию в металле шва горячих трещин. Например, температура плавления Fe2P равна 1290 0С.
Кроме того, в сталях и чугунах возможно образование фосфидной эвтектики,
состоящей из твердого раствора Fe, Fe3P, Fe3С и
имеющей температуру плавления 950 0С.
В нержавеющих Cr-Ni сталях и
никелевых сплавах возможна эвтектика Ni3P-Ni c Тпл = 880 0С.
Содержание фосфора в шихте
флюса может достигать 0,35 % и более. Фосфором загрязнены марганцовые руды,
используемые при изготовлении как флюсов, так и электродных покрытий. При плавке
шихты флюса содержание фосфора снижается. Но в высокомарганцовистых плавленых
флюсах количество фосфора находится на уровне до 0,15 %. В плавленых и
керамических флюсах, не содержащих марганцевой руды, концентрация фосфора не
превышает 0,05 %.
С целью уменьшить
отрицательное влияние фосфора на свойства металла прежде всего ограничивают его
содержание в основном и присадочных металлах (до 0,04 % в низкоуглеродистых и
до 0,02 % в легированных сталях). В сварочной проволоке, предназначенной для
сварки высокопрочных сталей, содержание фосфора не должно превышать 0,01 %. В
сварных швах оборудования АЭС во избежание радиационной хрупкости содержание
фосфора не должно быть выше 0,012 %.
Удаление фосфора из металла
в шлак осуществляют в два этапа. Вначале его окисляют, образуя P2O5, затем P2O5
связывают в комплексные соединения с основными или амфотерными окислами.
Образовавшееся комплексное соединение переходит в шлаковую фазу.
Окисление фосфора может
происходить по следующим реакциям:
2Fe3P + 5FeO ® P2O5
+ 11Fe; (4.41)
2Fe2P + 5FeO ® P2O5
+ 9Fe; (4.42)
По степени увеличения
химического сродства к Р2О5 оксиды расположены в следующий
ряд:
Fe2O3, Al2O3, FeO, MnO, MgO,
CaO.
Связывание фосфорного
ангидрида протекает по следующей реакции:
P2O5 + 3MnO ® (MnO)3×P2O5. (4.43)
Наиболее активно протекают
реакции:
P2O5 + 4CaO ® (CaO)4×P2O5. (4.44)
P2O5 + 3CaO ® (CaO)3×P2O5. (4.45)
В шлаке надо иметь избыток CaO, чтобы связать как P2O5, так и SiO2.
В противном случае возможна
реакция:
(CaO)4×P2O5
+ 2SiO2 ® 2(CaO)2×SiO2 + P2O5. (4.46)
При сварке под флюсом не
рекомендуется использовать повышенные плотности тока (Iд > 150¸200 dэ, где dэ в мм), так как в этом случае увеличивается степень
перехода фосфора из шлака в металл сварочной ванны.
Среди атмосферостойких
коррозионных сталей (АКС) применяют стали с повышенной концентрацией фосфора.
Например, стали марок 08ХГСБДП, 08ХГСДП, 10ХДП, в которых содержание S £ 0,035 %, а Р = 0,07¸0,12 %. Данные стали обладают повышенной коррозионной
стойкостью за счет образования пленки из оксидов хрома и фосфидов. При
продолжительных сроках эксплуатации на поверхности металла накапливается медь.
Стали используют для изготовления различных металлоконструкций зданий,
промышленных объектов, береговых сооружений.
Для РДС данных сталей
применяют электроды марки ОЗС-18 типа Э50А, которые обеспечивают в наплавленном
металле марганца до 1 %, фосфора не более 0,032%. Если принять долю участия
основного металла в металле шва g = 0,3; то по уравнению (4.47) можно рассчитать
ожидаемое содержание фосфора в металле шва:
[P]шв = g [P]о.м + (1 - g)
[P]н.м. (4.47)
Подставим соответствующие
величины в это уравнение:
[P]шв = 0,3×(0,07¸0,12) + 0,7×0,032 = (0,0424¸0,0584) %.
ДАЛЕЕ: 5.1.1. Поры в металле шва