Лекция №4
4 Основные способы получения наноматериалов
4.1 Физические методы синтеза наноматериалов
4.2 Химические методы синтеза
Наиболее распространенным способом получения малых структур и изделий в прошлом всегда являлось так называемое нисходящее (сверху вниз) производство, при котором изготовитель, пользуясь макроскопическими инструментами, удалял из крупной заготовки (или, наоборот, добавлял к ней) требуемые количества вещества, стараясь обеспечить, возможно, большую точность размеров. Такой подход при переходе к наномасштабным объектам приводит к непреодолимым техническим сложностям. Кроме того, любой процесс повышения точности механической обработки связан с рез ким возрастанием стоимости производства. В настоящее время мож но создавать некоторые наносисте мы, управляя движением атомов или небольших молекул на поверхности при помощи сканирующего туннельного микроскопа, а также облучая поверхность пучком ионов или электронов с очень небольшой длиной волны (порядка 0,05 нм), однако эти методы ост аются пока очень сложными и позволяют получать лишь штучные изделия.
Массовое, дешевое производство требует одновременного изготовления большого числа изделий. Один из стандартных подходов (примерами чего могут служить литография, штамповка, тиснение и печатное дело) к организации такого производства заключается в медленном и тщательном изготовлении исходного образца, с кото рого позднее простыми операциями можно получить огромное ко личество копий. Еще один подход, позволяющий избежать сложного и дорогостоящего процесса изготовления исходных наносистем, за ключается в использовании очень большого числа автоматических нано/микроманипуляторов, работающих параллельно.
Совершенно иной принцип связан с так называемым восходящим (снизу вверх) производством, при котором под действием физико-химических сил происходит «самосборка» компонентов. Примерами такой самосборки или самоорганизации могут служить процессы образования квантовых точек (представляющих собой двухмерные системы на полупроводниковой подложке с разными параметрами решетки) или формирование на поверхности золота монослоя из параллельно ориентированных алкан-тиоловых молекул с концевыми атомами. Приведенные примеры самоорганизации можно реализовать сравнительно простыми методами, однако формирование более сложных структур (например, трехмерных вычислительных и запоминающих элементов со всеми необходимыми связями) требует изощренной техники. Вдохновляющим примером для исследователей могут служить многие естественные биологические процессы (типа роста нервных окончаний), однако их воспроизведение в искусственных системах пока остается недоcтижимо.
Конечной целью нанотехнологий выступает разработка методов создания любых трехмерных образований (молекул и более сложных структур) из атомов заданного типа в заданном положении, что должно позволить «создавать и формировать мир, атом за атомом». Вообще говоря, такой подход подразумевает возможность создания даже таких систем и материалов, которые трудно или невозможно получить традиционными химическими методами, основанными на термодинамических или стохастических процессах. Единственным ограничением на этом пути могут стать фундаментальные законы природы, но общее направление представляется ясным: необходимо научиться осуществлять восходящие процессы, постепенно переходя от простой самосборки (т.е. овладевая методами «машинной» сборки на микро- и наноуровне) к моделированию сложных явлений, которые можно уподобить развитию живых организмов.
Известно, что структура и дисперсность (распределение зерен по размерам), а, следовательно, и свойства наноматериалов зависят от способа их получения. Рассмотрим основные из них.
4.1 Физические методы синтеза наноматериалов
4.1.1 Газофазный синтез
Чаще всего изолированные наночастицы получают испарением заготовки при контролируемой температуре в атмосфере инертного газа низкого давления с последующей конденсацией пара вблизи или на холодной поверхности. Газофазным синтезом обычно получают небольшие количества нанопорошков с размерами частиц от двух до нескольких сотен нанометров.
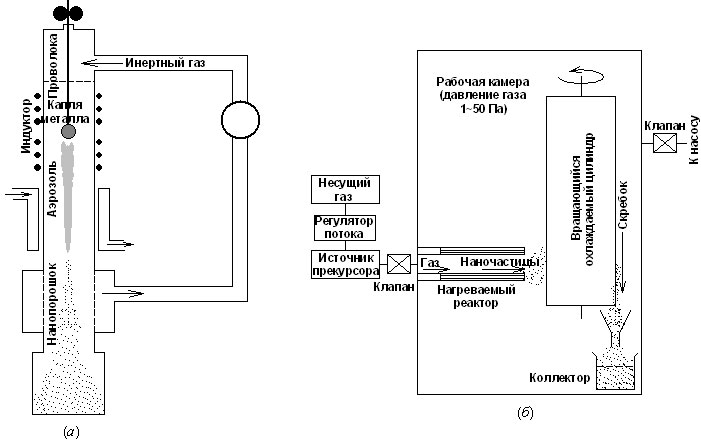
Схема газофазного синтеза
Рассмотрим основные закономерностями образования нанокристаллических частиц методом испарения и конденсации [5, 8, 9]:
1. Образование наночастиц происходит при охлаждении пара в зоне конденсации, которая тем больше, чем меньше давление газа. Внутренняя граница зоны конденсации находится вблизи испарителя, а ее внешняя граница по мере уменьшения давления газа может выйти за пределы реакционного сосуда. При давлении, равном нескольким сотням Па, внешняя граница зоны конденсации находится внутри реакционной камеры диаметром, не меньшим 0,1 м. В процессе конденсации существенную роль играют конвективные потоки газа.
2. При увеличении давления газа до нескольких сотен Па средний размер частиц сначала быстро увеличивается, а затем медленно приближается к предельному значению в области давлений более 2500 Па.
3. При одинаковом давлении инертного газа переход от гелия к ксенону, т.е. от менее плотного инертного газа к более плотному, сопровождается ростом размера частиц в несколько раз.
Недостатками газофазного синтеза являются трудности, возникающие при сборе полученного конденсацией нанокристаллического порошка, так как, его отдельные частицы настолько малы, что находятся в постоянном броуновском движении и остаются взвешенными в газе, не осаждаясь под действием силы тяжести. Для сбора получаемых порошков используют специальные фильтры и центробежное осаждение, в некоторых случаях применяется улавливание жидкой пленкой.

Наноалмазы, полученные газофазным синтезом
4.1.2 Плазмохимический синтез
Одним из самых распространенных химических методов получения высокодисперсных порошков нитридов, карбидов, боридов и оксидов является плазмохимический синтез [10]. Основными условиями получения высокодисперсных порошков этим методом являются протекание реакции вдали от равновесия и высокая скорость образования зародышей новой фазы при малой скорости их роста. В реальных условиях плазмохимического синтеза получение наночастиц целесообразно осуществлять за счет увеличения скорости охлаждения потока плазмы, в котором происходит конденсация из газовой фазы; благодаря этому уменьшается размер образующихся частиц, а также подавляется рост частиц путем их слияния при столкновении. При плазмохимическом синтезе используется низкотемпературная (4000-8000 К) азотная, аммиачная, углеводородная, аргоновая плазма дугового, тлеющего, высоко- или сверхвысокочастотного разрядов. В качестве исходного сырья применяют элементы, их галогениды и другие соединения. Характеристики получаемых порошков зависят от используемого сырья, технологии синтеза и типа плазмотрона. Частицы плазмохимических порошков являются монокристаллами и имеют размеры от 10 - 200 нм и более. Плазмохимический синтез обеспечивает высокие скорости образования и конденсации соединения и отличается достаточно высокой производительностью.

Главные недостатки плазмохимического синтеза: широкое распределение частиц по размерам и, вследствие этого, наличие довольно крупных (до 1-5 мкм) частиц, т.е. низкая селективность процесса, а также высокое содержание примесей в порошке.
К настоящему времени плазмохимическим методом получены высокодисперсные порошки оксидов магния, иттрия и алюминия, нитридов титана, циркония, гафния, ванадия, ниобия, тантала, бора, алюминия и кремния, карбидов титана, ниобия, тантала, вольфрама, бора и кремния [10-15].
Синтез оксидов в плазме электродугового разряда проводится путем испарения металла с последующим окислением паров или окислением частиц металла в кислородсодержащей плазме. Получаемые плазмохимическим синтезом порошки имеют правильную форму и размер частиц от 10 до 100 нм и более. С помощью плазмохимического синтеза можно получать также многокомпонентные ультрадисперсные порошки. В целом плазмохимический синтез с разными способами создания плазмы – один из наиболее перспективных методов получения разнообразных наноструктурных материалов.
4.1.3 Детонационный синтез и электровзрыв
Существует еще один вид механического воздействия, который одновременно создает условия, как для синтеза конечного продукта, так и для его диспергирования. Это ударная волна. Детонация взрывчатых веществ, т.е. энергия взрыва, достаточно широко, используется для осуществления фазовых переходов в веществах и детонационного синтеза. Детонационный синтез, как быстро протекающий процесс, позволяет получать тонкодисперсные порошки в динамических условиях, когда важную роль приобретают кинетические процессы.
В настоящее время наиболее широко детонационный синтез применяют для промышленного получения алмазных порошков различного технического назначения [16]. Также получают нанопорошки оксидов Аl, Мg, Тi , Zr [17, 18]. Слой исходного вещества (высокопористая металлическая среда, химическое соединение, соль или гель гидрооксида металла) подвергается ударно-волновому воздействию от контактного заряда взрывчатого вещества. В ударной волне происходит сжатие и прогрев высокопористого металла или же протекают реакции разложения исходного соединения до оксида с последующей стабилизацией оксидных фаз. После выхода ударной волны на свободную поверхность исходного вещества материал разлетается в газовую атмосферу взрывной камеры.
Если в качестве исходного вещества используются металлы, то применяется активная кислородсодержащая среда (например, смесь газов О2 + N2). В этом случае на стадии разлета происходит горение металла с образованием ультрадисперсного оксида. При использовании углеродсодержащей атмосферы СО2 удается синтезировать нанотрубки и сферические частицы углерода, а также нитевидные кристаллы МgO. Средний диаметр нитевидных кристаллов МgO составляет 60 нм, а отношение длины к диаметру достигает 100.
При использовании в качестве исходных материалов химических соединений применяется химически нейтральная по отношению к получаемому материалу газовая или жидкая среда. Благодаря этому происходит быстрое охлаждение вещества, и стабилизируются высокотемпературные и метастабильные кристаллические модификации (например, кубическая модификация ZrО2).
4.1 4 Упорядочение нестехиометрических соединений как метод создания наноструктур
Нанокристаллические керамические материалы интенсивно исследуются в последнее время в связи с необходимостью создания твердых и одновременно нехрупких, устойчивых к растрескиванию материалов. В этом отношении перспективны нестехиометрические карбиды переходных металлов IV и V групп, уступающие по твердости только алмазу и кубическому нитриду бора. Можно полагать, что превращения беспорядок-порядок, происходящие с изменением объема, могут применяться для формирования наноструктурного состояния и других материалов.
Сильно нестехиометрические соединения в неупорядоченном состоянии могут иметь до 50% структурных вакансий в неметаллической подрешетке [19]. При изменении температуры происходят фазовые переходы беспорядок-порядок, приводящие к образованию упорядоченных фаз со сложными сверхструктурами [20-22]. Превращения порядок-беспорядок, как правило, являются фазовыми переходами первого рода со скачкообразным изменением объема. Однако процесс упорядочения является диффузионным и поэтому превращение происходит не мгновенно, а в течение нескольких десятков минут. Если охлаждение осуществляется быстро, то процесс упорядочения не успевает закончиться и нестехиометрическое соединение остается в метастабильном неупорядоченном состоянии. Из-за различия параметров решеток неупорядоченной и упорядоченной фаз в образце возникают напряжения, которые с течением времени приводят к растрескиванию кристаллитов по границам раздела неупорядоченной и упорядоченной фаз. Регулируя размеры доменов упорядоченной фазы, можно получить наноструктурированные порошки нестехиометрических соединений.
4.1.5 Механосинтез
Механохимия изучает химические процессы, происходящие в момент механического воздействия на твердое вещество (трение, удар, прессование, взрывная волна и т.д.), и влияние предварительной механической обработки на реакционную способность и характеристики веществ [23, 24]. Собственно механоактивация представляет собой обработку порошков в мельницах с высокой энергонапряженностью, позволяющую достичь высоких степеней их диспергирования вплоть до наноразмеров.
Широкие возможности механохимии как химии нетепловых низкотемпературных реакций иллюстрирует тот факт, что в твердой фазе без растворения или плавления реагентов были синтезированы тугоплавкие вещества и интерметаллиды, неорганические и органические соединения, молекулярные комплексы, модифицированы полимеры и фармацевтические препараты, созданы композиционные материалы. Механохимические синтезы осуществляются при сравнительно низких температурах, когда формирование совершенной кристаллической структуры затруднено. Это открывает путь к синтезу веществ и материалов в нанокристаллическом и аморфном состояниях.
Основой механосинтеза является механическая обработка твердых смесей, в результате которой происходят измельчение и пластическая деформация веществ, ускоряется массоперенос и осуществляется перемешивание компонентов смеси на атомарном уровне, активируется химическое взаимодействие твердых реагентов [25-30].
В результате механического воздействия в приконтактных областях твердого вещества создается поле напряжений. Релаксация поля напряжений может происходить путем выделения тепла, образования новой поверхности, образования различных дефектов в кристаллах, возбуждения химических реакций в твердой фазе. Преимущественное направление релаксации зависит от свойств вещества, условий нагружения (мощность подведенной энергии, соотношение между давлением и сдвигом), размеров и формы частиц. По мере увеличения мощности механического импульса и времени воздействия происходит постепенный переход от релаксации путем выделения тепла к релаксации, связанной с разрушением, диспергированием и пластической деформацией материала и появлением аморфных структур различной природы. Наконец, каналом релаксации поля напряжений может быть химическая реакция, инициируемая разными механизмами. Среди таких механизмов — прямое возбуждение и разрыв связи, которые могут реализоваться в вершине трещины; локальный тепловой разогрев; безызлучательный распад экситонов и др.
Механическое воздействие при измельчении материалов является импульсным, поэтому возникновение поля напряжений и его последующая релаксация происходят не в течение всего времени пребывания частиц в реакторе, а только в момент соударения частиц и в короткое время после него. По этой причине при механохимическом синтезе нужно учитывать характер формирования поля напряжений во времени и кинетику последующих релаксационных процессов.
Механическое воздействие является не только импульсным, но и локальным, так как происходит не во всей массе твердого вещества, а лишь там, где возникает и затем релаксирует поле напряжений. Механическое истирание является наиболее производительным способом получения больших количеств нанокристаллических порошков различных материалов: оксидов, металлов, сплавов, интерметаллидов, керамики, композитов. В результате механического истирания и механического сплавления может быть достигнута полная растворимость в твердом состоянии таких элементов, взаимная растворимость которых в равновесных условиях пренебрежимо мала.
При механическом истирании порошков деформация первоначально локализуется в полосах сдвига, содержащих большое число дислокации с высокой плотностью. При достижении определенного уровня напряжений эти дислокации аннигилируют и рекомбинируют с малоугловыми границами, разделяющими отдельные зерна; на этом этапе истирания уже образуются зерна диаметром 20-30 нм и их количество растет по мере истирания. На следующем этапе истирания ориентация отдельных кристаллитов друг относительно друга становится случайной вследствие скольжения границ зерен.
Деформационное перемешивание на молекулярном уровне открыло возможность проведения химических реакций в смесях твердых веществ при комнатной температуре, когда диффузия практически заморожена. В литературе описаны сотни таких реакций, которые осуществлены на наковальнях Бриджмена [28, 29], в различных мельницах [30-34], аттриторах [35, 36], дезинтеграторах [37], на вальцах [38,39], в ударных волнах [40].
Очевидно, что существуют условия, в которых деформационное перемешивание смеси твердых реагентов завершается образованием новой кристаллической фазы продуктов реакции. Следовательно, упорядочение фазы продукта происходит в тех же условиях, что и разупорядочение кристаллической структуры исходных веществ.
Особенностью превращений упругой энергии в твердых телах является то, что в этом процессе в одних и тех же условиях тесно переплетены два на первый взгляд несовместимых процесса – распад и упорядочение кристаллических структур.
Для перемешивания компонентов на молекулярном (атомном) уровне благоприятным оказывается дестабилизирующее действие на кристаллы упругих напряжений. Образование кристаллических продуктов реакции свидетельствует о существовании тенденции к упорядочению. Чем больше равновесие реакции сдвинуто в сторону продуктов, тем сильнее проявляется эта тенденция.
В экзотермических реакционных смесях образование продукта сопровождается выделением тепла. В таких системах, варьируя интенсивность механической обработки и скорость теплоотвода, можно создать условия для механического инициирования теплового взрыва [41-44].
На начальной стадии механической обработки происходит уменьшение размеров частиц порошка, смесь перемешивается, растет площадь контакта реагентов. При этом в приповерхностной зоне начинает развиваться реакция и выделяется тепло. Пока частицы велики, степень их превращения мала и температура сохраняется на низком уровне. По мере увеличения поверхности контакта до нескольких квадратных метров на грамм скорость реакции увеличивается на столько, что тепло не отводиться и реакция переходит в режим самоускорения.
В реакционных смесях, для которых адиабатическая температура реакции равна или превышает температуру плавления одного из компонентов, а мощность дозы выше некоторого критического уровня, режим самоускорения сменяется тепловым взрывом [44].
C химической точки зрения наиболее перспективны реакции в смесях порошков и процессы механической активации твердых реагентов. В настоящее время в малых масштабах осуществляется синтез карбидов, боридов, силицидов, восстановление оксидов металлами, синтез ферритов, сверхпроводящей керамики и различных оксидных материалов. Однако накопленный в лабораториях опыт медленно осваивается в технике.
4.2 Химические методы синтеза
Химические методы синтеза исходных соединений основаны на том, что их получают путем выделения из растворов за счет различных химических реакций. Преимущества химических методов перед термическими в основном заключается в следующем [45]:
- за счет одновременного выделения всех компонентов из раствора достигается большая однородность их распределения (на молекулярном уровне);
- изменением условий осаждения регулируется дисперсность прокаленных порошков, размер частиц уменьшается до субмикронных значений;
- отсутствие помольных операций при изготовлении исходной смеси обеспечивает высокую чистоту конечных продуктов;
- выделенные из растворов соединения отличаются повышенной реакционной способностью, что приводит к образованию заданных составов при более низких температурах.
Существует большое число методов химического синтеза сложных соединений [46].
4.2.1 Метод совместного осаждения
Этот метод основан на взаимодействии щелочных реагентов с водными растворами солей, содержащих катионы различных металлов в необходимом соотношении. В качестве осадителей чаще всего применяют растворы щелочей, соды, гидроксида аммония и его смесей с карбонатом аммония. Полученный осадок подвергают термообработке. Совместным осаждением получают составы на основе цирконата-титаната свинца, титаната бария и т.д. [47].
4.2.2 Осаждение компонентов из растворов на твердую фазу
Метод заключается в осаждении различных соединений из растворов на заранее суспензированные в этих растворах твердые оксиды, гидроксиды или карбонаты металлов, углеродные материалы и другие носители. При этом между компонентами происходит физико-химическое взаимодействие, поэтому для образования из нее соединений и твердых растворов требуются более низкие температуры прокалки (сушки). Наибольший интерес представляет процесс выделения соединений из растворов на твердую фазу путем взаимодействия с осадителем [48]. Этот процесс особенно эффективен при синтезе ниобатов. При осаждении на оксид ниобия карбонатов двухвалентных металлов получают шихту для синтеза пирониобата, магнониобата свинца, метаниобатов свинца и щелочных металлов и другие соединения.
4.2.3 Оксалатный метод
Оксалатный метод основан на выделении из растворов труднорастворимых щавелевокислых комплексов, содержащих титан, цирконий, алюминий, щелочноземельные и другие металлы, и последующим их термическим разложением [45, 49-51].
Наибольшее значение этот метод приобрел при синтезе титаната бария. Титанилоксалат бария BaTiO(C2O4) .4Н2O синтезируют взаимодействием хлоридов бария и титана с щавелевой кислотой на холоду или при нагревании до 60-80 ° С. В промышленных условиях титанилоксалат бария производят сливанием растворов хлоридов бария и титана с нагретым до 80 ° С раствором щавелевой кислоты или путем вливания раствора щавелевой кислоты в смесь хлоридов:
TiCl4 + Pb(NO3) 2 + 2 H2C2O4 + Н2 O -----> Pb[TiO(C2O4)2] + 4 HCl + 2 HNO3
Важное значение имеет термический режим обработки полученных оксалатов. Необходимо учитывать, что при нагревании оксалатов сначала происходит их обезвоживание при 200-300 °С, затем разложение (~700 °С) с образованием промежуточных соединений, которые при температуре ~1000 °С превращаются в искомое соединение. Режим прокалки предопределяет дисперсность полученного порошка: повышение температуры прокалки приводит к спеканию частиц и уменьшению удельной поверхности порошка от 3-4 до 1-2 кв.м/г.
4.2.4 Золь-гель метод
Золь-гель метод основан на переводе свежеосажденных соединений (обычно гидроксидов) в коллоидное состояние. Для образования золей используют длительную пептизацию осадков в воде, кислотах, растворах солей или электроионизацию (электродиализ). Удаление воды из золей с переводом их в гели, а затем в сыпучие порошки проводится сушкой или экстракцией воды органическими растворителями с последующей прокалкой [52, 53]. Метод дает возможность получать мелкодисперсные порошки соединений заданного состава.
Золь-гель метод может быть подразделен на две разновидности: с использованием в качестве исходных веществ неорганических соединений и с использованием металлорганических соединений – алкоголятов (алкоксидный синтез).
Золь-гель методом с использованием неорганических веществ можно получать титанаты и цирконаты щелочноземельных металлов, а также других твердых растворов на их основе [54]. Например, для синтеза титаната бария к водному раствору хлорида титана при непрерывном перемешивании добавляют водный раствор осадителя ( NH4OH , NaOH и др.). Затем к суспензии образовавшегося гидроксида добавляют при перемешивании водный раствор, содержащий катионы Ba(2+). Образующийся осадок фильтруют, промывают, высушивают и прокаливают. Полученный после сушки порошок имеет высокую удельную поверхность (~200 кв.м/г), которая резко уменьшается с повышением температуры и времени термообработки.
Перспективным направлением золь-гель метода является также алкоксидный синтез, который включает в себя следующие стадии:
- приготовление смешанных сложных растворов в органическом растворителе, содержащих в себе все необходимые элементы в заданной пропорции;
- гидролиз растворов;
- термообработка продуктов гидролиза.
В качестве исходных веществ в алкоксидном синтезе применяют этилаты, бутилаты, пропионаты металлов. Полученные порошки отличаются высокой дисперсностью (~20-30 кв.м/г), которая уменьшается при прокалке. Алкоксидная технология успешно применяется для синтеза титанатов щелочноземельных металлов и свинца, сложных перовскитов, твердых растворов на основе цирконата титаната свинца, титаната бария BaTiO3 и других композиций [55-58].
4.2.5 Гидротермальный синтез
Гидротермальный синтез основан на реакциях гетерогенного взаимодействия, протекающих в специальных условиях между гидроксидами или оксидами, находящимися в твердой фазе, или ионами металлов, присутствующими в растворах солей или оснований. В качестве специальных условий выступают высокая температура (200-400 ° С) и высокое давление (до 300-500 атм.), т.е. реакция проходит в автоклавах [59].
Гидротермальным синтезом можно получать различные композиции на основе ЦТС. Порошки полученных соединений имеют высокую дисперсность, форму частиц, близкую к сферической, и узкое распределение частиц по размерам [60-62].
Химический синтез исходных соединений не исчерпывается перечисленными методами. Успешно применяются также разновидности распылительной сушки растворов или обжига, плазмохимический синтез, криохимический процесс вымораживания солей и некоторые другие технологии. Выбор метода синтеза определяется технико-экономическими соображениями в каждом конкретном случае.