Лабораторная работа №4
Синтез и исследование свойств нанокатализаторов на углеродном носителе и
наносорбентов
ЧАСТЬ 1
Синтез нанокатализаторов на углеродном носителе
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Цель работы – сравнение эффективности различных восстановителей для жидкофазного синтеза наноразмерных электрокатализаторов.
В настоящее время человечество сталкивается со следующими экологическими проблемами: смог, парниковый эффект, озоновые дыры, кислотные дожди и т.д. [1]. Причиной большинства из них является массированное загрязнение окружающей среды в результате не рационального природо-пользования. Основные выбросы вредных компонентов возникают в ходе горения топлива (рис.1).
Следует отметить, что процессы преобразования химической энергии в электрическую характеризуется невысокими значениями КПД (20-30%). Вместе с тем известны способы преобразования энергии, например, электрохимический, практически лишенный указанных недостатков. Осуществляется он в топливных элементах (ТЭ) [ 2 ] .
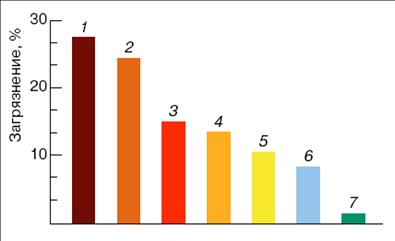
Рис. 1. Доли загрязнений атмосферы различными отраслями техники в России: 1 – теплоэнергетика; 2 – черная металлургия; 3 – нефтедобыча и нефтепереработка; 4 – автотранспорт; 5 – цветная металлургия; 6 – промышленность стройматериалов; 7 – химическая промышленность
Топливный элемент – это устройство, в котором химическая энергия топлива и окислителя, непрерывно подводимых к электродам, превращается непосредственно в электрическую. В тепловых машинах процесс преобразования энергии проходит через несколько промежуточных стадий (рис.2).
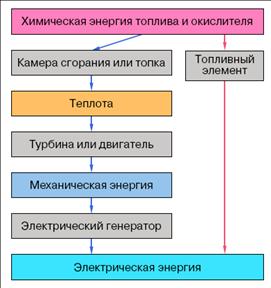
Рис. 2. Ступени преобразования химической энергии традиционным и электрохимическим способами
В качестве топлива обычно используют водород, реже СО или СН 4, окислителем является кислород воздуха. ТЭ бывают двух типов:
1) низкотемпературные - t < 200 o C , топливо – водород или метанол, катализатор – Pt и ее сплавы;
2) высокотемпературные - t > 500 o C , топливо – водород, СО, СН 4, электролиты – расплавы солей или твердый электролит, катализаторы – никель/хром, литированный оксид никеля, сложные смешанные оксиды циркония-лантана и др.
Рассмотрим для примера работу кислородно-водородного ТЭ со щелочным электролитом (раствором КОН).
Реакция окисления воды:
2 H 2 + O 2 > 2 H 2 O (1)
В ТЭ протекает через электроокисление водорода на аноде:
2 H 2 + 4 OH - - 4 e > 4 H 2 O (2)
и электровосстановление кислорода на катоде:
O 2 + 2 H 2 O + 4 e > 4 OH - (3)
В результате реакции (1) во внешней цепи протекает электрический ток, т.е. происходит прямое преобразование химической энергии в электрическую.
ЭДС для ТЭ можно рассчитать по уравнениям химической термодинамики (4):
![]() , (4)
, (4)
где Еэ – ЭДС; D G х.р. – изменение энергии Гиббса в результате протекания химической реакции; n – число электронов на молекулу реагента; F – постоянная Фарадея (96 484 Кл/моль). Так для реакции (1) - Еэ , 298 = 1,23 В.
Так как процесс преобразования энергии не имеет промежуточной стадии генерации теплоты (см. рис.2), то для электрохимического способа нет ограничений цикла Карно и теоретический КПД преобразования энергии можно рассчитать по формуле:
![]() , (5)
, (5)
где D Нх.р. – изменение энтальпии в результате протекания химической реакции (тепловой эффект реакции). Например, для метана h Т = 1,0, а для водорода h Т =0,94.
Реальный КПД h р ТЭ ниже теоретического и определяется по уравнению:
![]() , (6)
, (6)
где n р – реальное число электронов на молекулу реагента, U – напряжение ТЭ.
У большинства ТЭ напряжение лежит в пределах 0,8 ? 09 В. От величины напряжения зависит мощность ТЭ:
P = U I.
Принципиальная схема ТЭ представлена на рисунке 3. Топливные элементы, как и другие химические источники тока (гальванические элементы и аккумуляторы), состоят из анода, катода и ионного проводника (электролита) между ними. Основное отличие ТЭ от гальванического элемента заключается в том, что в ТЭ используются нерасходуемые электроды, поэтому ТЭ могут работать длительное время (до нескольких десятков тысяч часов). Реагенты в ТЭ поступают во время работы, а не закладываются заранее, как в гальванических элементах и аккумуляторах. В отличие от аккумуляторов ТЭ не требуют подзарядки.
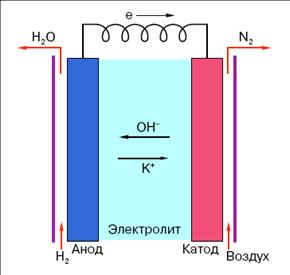
Рис. 3. Принципиальная схема ТЭ
В процессе работы характеристики ТЭ постепенно ухудшаются, что обусловлено дезактивацией и износом катализаторов, коррозией основ электродов, изменением структуры электродов и другими причинами. Это сокращает их срок службы. Для увеличения срока службы ТЭ применяют химически стойкие катализаторы (платиновые металлы и оксиды некоторых металлов) и основы электродов (графит и никель). Некоторые ТЭ могут работать до 40 тыс. часов. Согласно прогнозам в скором будущем энергоустановки на основе ТЭ будут вносить существенный вклад в генерацию энергии и решение экологических проблем транспорта и энергетики.
Экспериментальная часть
Важнейшую роль в работе ТЭ играет катализатор. Он должен иметь большую площадь поверхности, высокую удельную активность, невысокое содержание драгметаллов. Совокупность этих параметров достигается при переходе в наномасштаб, т.к. п лощадь поверхности частиц катализатора растет с уменьшением размера наночастиц, однако удельная каталитическая активность при этом уменьшается. Антибатное влияние двух этих факторов обусловливает наличие оптимального размера наночастиц, примерно 2,5 ? 4 nm . В настоящее время получить такие частицы удается с помощью жидкофазного синтеза в водно-органических средах, восстанавливая частицы металла на углеродном носителе:
H 2PtCl 6 + Red > Pt + 2 HCl + RedCl 4
В качестве восстановителя (Red) используют этиленгликоль ( полиольный синтез ), тетраборат натрия (NaBH 4), гидроксиламин гидрохлорид (NH2OH * HCl), гипофосфит натрия ( NaH 2PO 3 ), гидразин ( N 2H 4*H 2O ) и др .
В качестве среды используют водные растворы этиленгликоля, глицерина и др.
Деградация катализатора в ходе работы ТЭ происходит из-за агломерации наночастиц и потери контакта с основой из-за коррозии углерода. Путь решения – использование сплавов Pt вместо чистой платины (Pt-Co, Pt-Ni, Pt-Co-Fe и др.)
Оборудование и материалы:
- термометр для измерения температуры;
- набор посуды: стаканы на 100 мл, колбы на 100 мл, мерные цилиндры на 100 и 10 мл;
- магнитная мешалка;
- песчаная печь;
- весы;
- установка для вакуумного фильтрования;
- фильтры «синяя лента»;
- реактивы, согласно заданию преподавателя;
- СИЗ: х/б халат, резиновые перчатки, очки.
Требования безопасности
Перед началом работы необходимо пройти инструктаж по технике безопасности и получить допуск к работе у преподавателя.
Подготовку и проведение эксперимента следует проводить в вытяжном шкафу при включенной вентиляции в х/б халате, отбор едких жидкостей производить в резиновых перчатках и в очках.
Рабочее место должно удовлетворять санитарно-гигиеническим требованиям ГОСТ 12.1.005-2001 и требованиям пожарной безопасности по ГОСТ 12.1.004-91.
Порядок выполнения работы
- В соответствии с заданием преподавателя получите у лаборанта необходимый набор посуды и реактивов.
- Взвесьте 0,1 г углеродного носителя и поместите его в стакан емкостью 100 мл, добавьте 40 мл этиленгликоля, 10 мл воды, 10 мл NH4OH и поставьте на 15 минут на магнитную мешалку, опустив в стакан магнит.
- Рассчитайте необходимое количество нитрата никеля Ni(NO3)2*6H2O (М r =290,794) для восстановления из него 0,1 г металлического никеля (М r =58,693), взвесьте и добавьте в стакан для смешивания с углеродным носителем.
- Поставьте стакан на песочную печь для нагревания до 80 градусов.
- Поместив стакан на магнитную мешалку, добавьте восстановитель. Через 30 минут профильтруйте реакционную смесь через фильтр «синяя лента» на воронке Бюхнера с помощью вакуумного насоса под вытяжным шкафом. Промойте осадок дистиллированной водой.
- Поместите фильтр с осадком в чашку Петри и просушите его в сушильном шкафу при температуре 120 С.
- После просушки отделите осадок от фильтра и взвесьте его.
- Рассчитайте выход продукта (%) по формуле:
D =( m практ. *100%) / m теорет. ,
где m практ. – масса полученного продукта,
m теорет. – масса теоретически ожидаемого продукта ( 0,1 г углеродного носителя + 0,1 г никеля = 0,2 г продукта).
- Занесите результаты эксперимента в табл. 1.
- Таблица 1
-
№
опыта
Восстановитель
Материал-носитель катализатора
Выход продукта,
%
1
NaBH 4
2
NaH 2PO 3
3
-//-
Т
Содержание отчета
- Цель работы.
- Ответы на контрольные вопросы.
- Ход работы и расчет количества реагентов.
- Таблица с результатами опытов.
- Вывод об эффективности различных восстановителей, используемых для получения частиц металла на углеродном носителе.
Контрольные вопросы
- С какими основными экологическими проблемами сталкивается в настоящее время человечество?
- Что понимают под топливным элементом, относится ли он к экологически чистым источникам энергии?
- Что используют в качестве топлива и окислителя в ТЭ?
- Перечислите типы ТЭ.
- Поясните работу кислородно-водородного ТЭ со щелочным электролитом .
- Как рассчитать ЭДС, КПД, мощность ТЭ?
- Изобразите принципиальную схему ТЭ.
- Чем обусловлено снижение характеристик ТЭ и как продлить срок его службы?
- Какие требования предъявляются к катализатору, используемому в ТЭ, какова его роль?
- Какие вещества используют в качестве восстановителей металлических частиц, в каких средах?
- Каковы причины деградации катализатора?
- Приведите общий вид реакции восстановления на примере платины и никеля.
- Синтез металлических катализаторов на углеродном носителе относится к восходящим или нисходящим технологиям?
ЧАСТЬ 2
Определение размера
областей когерентного трассеяния (ОКР)
методом Шеррера
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Цель работы – определить размер ОКР методом Шеррера.
Для определения среднего диаметра наночастиц на углеродном носителе часто используют рентгеноспектральный анализ.
Реальные кристаллы содержат различные несовершенства структуры - дефекты, которые во многом определяют их физические, а иногда и химические свойства. Эти несовершенства структуры в дифракционной картине проявляются как эффекты второго порядка, поэтому при рентгеноструктурном исследовании в первую очередь определяется усредненная, идеальная структура и с большим трудом - отклонения от этой идеальной структуры.
В рентгеноспектральном анализе используются формулы для дифракции рентгеновского излучения, выведенные для идеально-мозаичных кристаллов, когда для реального кристалла предполагается модель, по которой они содержат области с совершенной структурой (области когерентного рассеяния, ОКР), несколько разориентированные друг относительно друга. При размерах ОКР около 1000 ? доля граничных областей с несколько искаженной структурой мала и практически не отражается на дифракционной картине. Размер ОКР обычно меньше размеров частиц, т.к. каждая частица может содержать не одну ОКР, а несколько, поэтому отождествление размеров ОКР и частиц неправомерно. Иногда ОКР называются кристаллитами, что и может создать подобную иллюзию. Лишь при малых размерах ОКР (меньше 100 ?) это различие становится малосущественным. Такая дисперсность характерна, например, для большинства катализаторов, и в этом случае определение размеров ОКР эквивалентно определению размеров частиц.
Малые размеры ОКР вызывают уширение линий, но это не единственная причина уширения, так как похожий эффект может быть вызван колебаниями в величинах параметров элементарных ячеек в пределах образца (определяется экспериментально среднее значение). Такая не вполне строгая периодичность связана с образованием вакансий или внедрением избыточных атомов. Если она не вызывает изменения в дальнем порядке, то влияние этих дефектов (микроискажений, микронапряжений) также отражается в ширине линий. Наконец, возможно статистическое смещение атомов из равновесных положений. Их влияние на дифракционную картину напоминает влияние тепловых колебаний: интенсивность линий уменьшается, а диффузное рассеяние ("фон") увеличивается.
При малых величинах (меньше 500 А) кристаллитов (точнее, блоков когерентного рассеяния) начинает появляться заметное расширение линий на рентгенограммах. В этом случае правомерно использование приближенного метода Смелякова-Шеррера для определения размера частиц. При сравнении результатов расчета по этому методу с результатами, полученными с помощью электронной микроскопии, разница составляет 10-20%.
С использованием метода Смелякова-Шеррера по полуширине (?) самого интенсивного дифракционного отражения можно рассчитать размер частиц полученного материала по формуле:
![]() , (7)
, (7)
где l – длина волны медного излучения (1,54178), ? – полуширина отражения и ? – угол отражения (радианы), К – поправочный коэффициент (в данной работе примем К=1).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пример расчета:
- Определите по таблице 2 элемент, осажденный на углеродный носитель.
-
Определите с помощью экспериментально полученной рентгенограммы (рис. 4) середину пика в градусах - 2?=39,75, рассчитайте угол отражения: ?=39,75/2=19,875.
- Определите полуширину пика: ?=40,75-38,6=2,15 градуса.
- Подставьте найденные значения в формулу (7), учитывая переводной коэффициент градус-радианы, равный 0,017453:
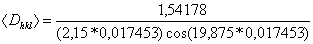 =
=
=41,249 ангстрем = 4,1249 нм
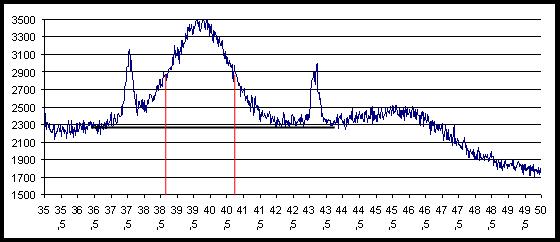
Рис. 4. Рентгенограмма
Таблица 2
Элемент |
Простр. группа |
Параметр элемент. ячейки, a |
Угол отраж., 2 ? |
Инт-ть отражения, I |
hkl |
Pt |
Fm 3 m |
3,923 |
39,798 |
100 |
111 |
46,283 |
53 |
200 |
|||
67,518 |
31 |
220 |
|||
Ni |
Fm 3 m |
3,523 |
45,505 |
100 |
111 |
51,844 |
42 |
200 |
|||
76,366 |
21 |
220 |
|||
Fe |
Im 3 m |
2,866 |
44,671 |
100 |
110 |
65,018 |
20 |
200 |
|||
82,329 |
30 |
211 |
|||
Fe |
Fm3m |
3,43
|
45,782 |
100 |
111 |
53,379 |
42 |
200 |
|||
78,87 |
17 |
220 |
Содержание отчета
- Цель работы.
- Ответы на контрольные вопросы.
- Расчет.
Контрольные вопросы
1. С помощью каких методов можно определить размер наночастиц?
2. Что такое ОКР?
3. Можно ли отождествлять размер ОКР с размером частиц? Почему?
4. С чем связаны неточности в расчетах размеров частиц с помощью рентгеноспектрального метода?
5. Что влияет на ширину дифракционных пиков?
6. При каких размерах частиц можно использовать формулу Смелякова-Шеррера?
ЧАСТЬ 3
Синтез и исследование сорбционной активности
гидроксидов d - и p -элементов
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Цель работы – используя золь-гель технологии синтезировать гидроксид алюминия, сравнить его сорбционную активность в отношении ионов тяжелых металлов.
Методы очистки сточных вод можно условно разделить на следующие группы: механические, физико-химические, биологические, локальные, деструкционные. Наиболее часто на машиностроительных предприятиях применяют физико-химические методы, одним из которых является коагуляция.
Коагуляция (от лат. coagulatio- свертывание, сгущение) - объединение частиц дисперсной фазы в агрегаты вследствие сцепления ( адгезии) частиц при их соударениях. Соударения происходят в результате броуновского движения, а также седиментации, перемещения частиц в электрическом поле (электрокоагуляция), механического воздействия на систему ( перемешивания, вибрации) и др. Характерные признаки коагуляции - увеличение мутности (интенсивности рассеиваемого света), появление хлопьевидных образований - флокул (отсюда термин флокуляция, часто используемый как синоним коагуляции), расслоение исходно устойчивой к седиментации системы ( золя) с выделением дисперсной фазы в виде коагулята (осадка, сливок).
Зачастую коагуляция сопровождается сорбцией, что широко используется при очистке сточных вод от различных загрязнителей.
Сорбция - это поглощение газов, паров или растворенных веществ жидкими или твердыми сорбентами. Различают четыре вида сорбции:
- абсорбция – поглощение газов, паров, растворенных веществ всем объемом твердой или жидкой фазы;
- адсорбция – поглощение веществ поверхностью твердого или жидкого сорбента;
- хемосорбция – поглощение веществ жидким или твердым сорбентом с образованием химических соединений;
- капиллярная конденсация - образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров веществ.
Для очистки сточных вод чаще всего применяют твердые адсорбенты (ни один из которых не является универсальным). Их можно разделить на следующие группы:
1) гидрофильные неорганические материалы типа силикагелей ( SiO 2 ? х H 2 O ) и молекулярных сит (цеолиты - Na 2 O - A 1 2 O 3 – n SiO 2 • Н 2О);
2) гидрофобные неорганические материалы – активированные угли;
3) синтетические макропористые органические материалы с высокой степенью гидрофобности и небольшой удельной поверхностью – это пористые полимеры;
4) непористые неорганические сорбенты (сульфат меди, сульфат магния, хлорид кальция, гидроксид калия, поташ, каолин).
Наиболее эффективными для сорбции из воды ионов тяжелых металлов являются активированные угли.
Активированные угли являются неполярными сорбентами с сильно развитой пористой структурой. Имеют поры различного диаметра: микропоры (1-2 нм), поры переходного диаметра (5-50 нм) и макропоры (>100 нм). Угли получают путем карбонизации природных материалов: дерева, косточек, скорлупы, а также синтетических материалов фенолоформальдегидных смол и поливинилиденхлоридов. При карбонизации углеродных материалов образуется продукт с очень низкой сорбционной способностью, удельная поверхность которого составляет несколько квадратных метров на 1 г сорбента. Для повышения сорбционной способности угли активируют водяным паром или диоксидом углерода. В процессе активации поверхность освобождается от дегтя и частично от аморфного углерода, в результате чего сильно увеличивается его пористая поверхность и как следствие сорбционная емкость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и материалы:
1. Химическая посуда: стаканы на 100 мл, колбы на 200 мл, мерные цилиндры.
2. Реактивы: сухие соли: хлорид никеля, сульфат меди, хлорид хрома ( III ), сульфат алюминия, 5% р-р аммиака, р-р соляной кислоты, универсальная индикаторная бумага, активированный уголь.
3. Оборудование: весы аналитические, вытяжной шкаф.
4. СИЗ: х/б халаты, защитные очки, перчатки резиновые.
Ход работы
- В соответствии с полученным заданием синтезируйте гидроксид алюминия по реакции:
Al 3 + + OH - « Al ( OH ) 3 ? .
- С помощью универсальной индикаторной бумаги измеряйте pH , уровень которого должен находиться в пределах 6,5 ? 7,5. Коррекцию рН проводите с использованием раствора соляной кислоты.
- Прилейте к полученному осадку 10 мл раствора соли одного из тяжелых металлов, интенсивно перемешайте и дайте отстояться в течение 15 минут.
- Визуально отметьте изменение окраски.
- Сравните сорбционную активность гидроксида алюминия с активированным углем, добавив к растворам соответствующих солей по 0.5 мг С акт.
- Запишите наблюдения.
Выводы
По результатам проведенных исследований сделайте вывод о степени эффективности очистки воды от катионов тяжелых металлов с использованием различных сорбентов.
Содержание отчета
- Цель работы.
- Ответы на контрольные вопросы.
- Наблюдения, уравнения реакций.
- Выводы.
Контрольные вопросы
1. Перечислите методы очистки сточных вод.
2. К какому типу методов очистки воды можно отнести извлечение ионов тяжелых металлов из раствора с помощью сорбентов?
3. Что называют коагуляцией?
4. Каковы признаки коагуляции?
5. Приведите определение и виды сорбции.
6. Какие вам известны адсорбенты?
7. Что из себя представляет активированный уголь, как его получают и активируют?
Литература
- Пустовая Л.Е., Аствацатуров А.Е., Озерянская В.В. Общая экология: учеб. пособие для техн. ВУЗов - Ростов н/Д: Издательский центр ДГТУ, 2004, С. 102
- Коровин Н.В. Топливные элементы / Соросовский образовательный журнал, №10, 1998. с. 55-59
-
Пустовая Л.Е., Гутерман В.Е., Гутерман А.В., Высочина Л.Л. Боргидридный синтез Ptx-Ni/C- электрокатализаторов и исследование их активности в реакции электровосстановления кислорода / Электрохимия. - 2007. Т.43, сентябрь, №9. с. 1147-1152
-
Нестеров А. А., Пустовая Л.Е. Введение в теорию и практику синтеза оксидных фаз: учеб. пособие. - Ростов н/Д: Издательский центр ДГТУ, 2008, С. 196
- Пустовая Л.Е., Месхи Б.Ч. Методы и приборы контроля окружающей среды. Экологический мониторинг: учеб. пособие. - Ростов н/Д: Издательский центр ДГТУ, 2008, С. 219