Ю. М. Наследников, А. Я. Шполянский, А. П. Кудря, А. Г. Стибаев.
Структурно-содержательный тест для повторения и задания
к разделу 3
3.1. Укажите историческую последовательность становления четырех концептуально-конструктивных уровней современной химии, приведенных ниже.
А. Учение о химических процессах. Б. Учение о составе.
В. Эволюционная химия. Г. Структурная химия.
3.2. Укажите правильную последовательность в исторической иерархии химических моделей вещества (от более простых к более сложному):
А. Стехиометрическая модель. Б. Геометрическая (структурная) модель. В. Электронная модель. Г. Атомно-молекулярная модель.
Д. Эволюционная модель развития и самоорганизации элементарных каталитических систем.
3.3. Укажите правильную последовательность в структурной иерархии объектов химии (от большего к меньшему):
А. Химические соединения (органические, неорганические).
Б. Вещества (дальтониды и бертоллиды, гомогенные и гетерогенные). В. Химические элементы. Г. Атомы.
Д. Молекулы. Е. Ядра атомов. З. Электроны.
3.4. В рамках концепции целостности атомов и молекул и единства реагентов и продуктов реакции каждому основному понятию химии, указанному в левой колонке, подберите соответствующее определение, приведенное в правой колонке.
3.5. Чем определяется место и свойства химического элемента в периодической системе химических элементов Д.И. Менделеева?
А. Атомной массой Б. Зарядом ядра атома
Примечание. В неклассической химии, очевидно, правильней говорить о связи химических свойств элемента с его ядерно-электронным строением, а не просто с зарядом ядра. В этом плане характерны различия в химических свойствах изотопов водорода: протия, трития, дейтерия, а также отступления от последовательного заполнения подоболочек электронной конфигурации атома.
Итак, суть проблемы химического элемента раскрылась в физико-химическом смысле периодического закона и в квантово-механическом объяснении понятия электронной оболочки и принципа Паули. А проблема химического соединения состоит не столько в постоянстве состава, сколько в природе химических связей.
3.6. В рамках электронной модели современной химии типам химических связей, указанным в левой колонке, приведите в соответствие основные характерные особенности этих связей, приведенные в правой колонке.
1. Ковалентная связь |
А. Взаимодействие между атомами обусловлено тем, что два электрона принадлежат одновременно двум атомам. В обобщенных парах электронов важную роль начинает играть обменная энергия, которая является существенно квантовой и зависит от плотности зарядов p12 (r). |
3.7. В рамках структурной химии отберите проблемы, относящиеся к неорганической (1) и органической (2) химии, из приведенных ниже.
А. По современным представлениям, структура молекул – это пространственная и энергетическая упорядоченность квантово-механической системы, состоящей из атомных ядер и электронов. Органические соединения – структурные образования из органических молекул.
Б. Структура неорганических соединений взаимосвязана с химией твердого тела, пересекающейся с квантовой физикой твердого тела. Структура задается квантово-механическим взаимодействием неорганических молекул и атомов химических элементов.
3.8. Основным законам и принципам учения о химических процессах, указанным в левой колонке, подберите соответствующие формулы и определения, приведенные в правой колонке.
1. Закон Аррениуса 2.Правило Вант-Гоффа 3.Принцип Ле-Шателье 4. Закон действующих масс |
А. Скорость химических реакций при постоянной температуре пропорциональна произведению концентраций реагирующих веществ: |
3.9. Условия протекания химических процессов в современной химии становятся зависимыми не только от термодинамических (температуры, давления и т.п.), но и структурно-кинетических факторов: строения исходных реагентов; их концентрации; наличия в реакторе катализаторов (или ингибиторов) и других добавок; способов смешивания реагентов, материалов и конструкции реактора и т.п. Влияние такого типа факторов, воздействие которых зачастую носит неконтролируемый характер, может быть сведено к катализу.
В рамках концепции неконтролируемого воздействия в химии каждому термину, указанному в левой колонке, подберите соответствующее определение, приведенное в правой колонке.
1. Катализ |
А. Ускорение химической реакции в присутствии веществ-катализаторов, которые взаимодействуют с реагентом, но в реакции не расходуются и не входят в состав конечного продукта. |
Примечание. Катализ играет решающую роль в процессе перехода от химических систем к биологическим, а также к проблемам эволюционной химии.
3.10. Не прибегая к вычислениям, укажите, в каких процессах энтропия уменьшается:
А. NH4NO2(к) -> N2O(г) + 2H2O(ж)
Б. 2N2(г) + O2(г) -> 2N2O(г)
В. 2H2(г) + CO(г) -> CH3OH(ж)
Г. S(г) -> S(ж)
3.11. В рамках эволюционной химии выделите два подхода к проблеме самоорганизации предбиологических систем: субстратный (1) и функциональный (2) на основе кратких характеристик их отличительных черт, приведенных ниже.
А. Отличительная черта состоит в исследовании вещественной основы биологических систем, т. е. определенного состава элементов-органогенов и определенной структуры, входящих в живой организм химических соединений.
Б. Отличительная черта состоит в исследовании процессов самоорганизации предбиологических систем, выявлении законов, которым подчиняются такие процессы. Теория саморазвития элементарных каталитических систем в самом общем виде является общей теорией химической эволюции и биогенеза.
| Назад| Содержание| Вперед |
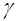 раз:
раз: