4.3. Уравнение Клапейрона-Клаузиуса
Две любые фазы вещества могут находиться в равновесии лишь при определенном давлении, которое зависит от температуры. Получим вид этой зависимости, используя понятие энтропии. Обозначим энтропии данных фаз S1 и S2, число частиц каждой фазы N1 и N2, химпотенциалы μ1 и μ2. Считая P = f(T), продифференцируем уравнение (4.7):
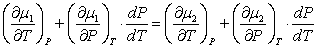 . (4.9)
. (4.9)
С учетом того, что 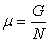 ,
, 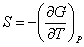 ,
, 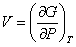 и обозначив удельные энтропии и удельные объемы систем соответственно S1о = S1/N1, S2о = S2/N2,
и обозначив удельные энтропии и удельные объемы систем соответственно S1о = S1/N1, S2о = S2/N2,
V1o =V1/N1 и V2o =V2/N2, получим 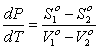 ; но
; но 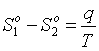 , где q – удельная скрытая теплота перехода. Тогда окончательно
, где q – удельная скрытая теплота перехода. Тогда окончательно
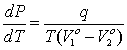 . (4.10)
. (4.10)
Формула (4.10) представляет собой уравнение Клапейрона-Клаузиуса, и применяется для поиска температуры фазового равновесия в зависимости от давления.