2.2.3. Заполнение зон электронами.
Металлы, диэлектрики, полупроводники
- Рассмотрим различные варианты заполнения зон электронами. Пусть последняя зона, в которой есть электроны, заполнена частично. Поскольку эта зона заполняется валентными электронами, ее называют валентной зоной. Под действием электрического поля электроны, находящиеся вблизи границы заполнения, будут ускоряться и переходить на более высокие свободные уровни той же зоны. В кристалле потечет ток. Таким образом, кристаллы с частично заполненной валентной зоной хорошо проводят ток, то есть являются металлами. Это такие одновалентные металлы, как натрий и другие щелочные металлы, у них при 0 К последняя зона, в которой есть электроны, заполнена наполовину (рис 2.9,а).
- Пусть валентная зона заполнена электронами полностью, но она перекрывается со следующей разрешенной зоной, не занятой электронами. Если к такому кристаллу приложить внешнее электрическое поле, то электроны будут переходить на уровни свободной зоны и возникает ток. Данный кристалл тоже является металлом, типичный пример – двухвалентный магний (рис. 2.9,б).
- Пусть валентная зона заполнена электронами полностью и отделена от следующей за ней свободной зоны широкой (>2÷3 эВ) запрещенной зоной (энергетической щелью). В кристалле с такой зонной структурой внешнее поле не может создать электрического тока, так как электроны в заполненной зоне не могут изменить своей энергии. Такое вещество представляет собой диэлектрик (рис. 2.9,в). Типичный диэлектрик – ионный кристалл NaCl.
- Пусть валентная зона заполнена электронами полностью и отделена от следующей за ней свободной зоны энергетической щелью шириной менее 2÷3 эВ, то кристалл называется полупроводником. В полупроводниках энергия теплового движения (которая имеет порядок kT) оказывается достаточной для того, чтобы перевести часть электронов в верхнюю свободную зону. Свободная зона является для них зоной проводимости (рис. 2.9,г). При очень низких температурах любой полупроводник становится хорошим диэлектриком.
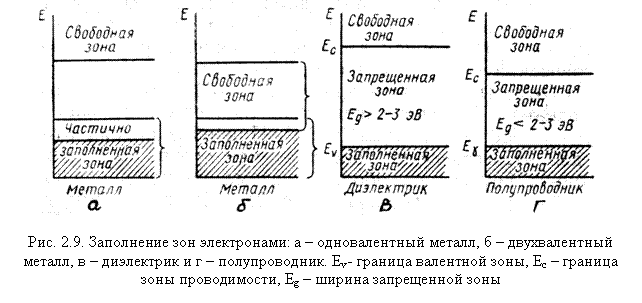
Таким образом, между металлами и диэлектриками существует принципиальное различие, а между диэлектриками и полупроводниками – только количественное.
Рассмотрим некоторые примеры образования энергетических зон:
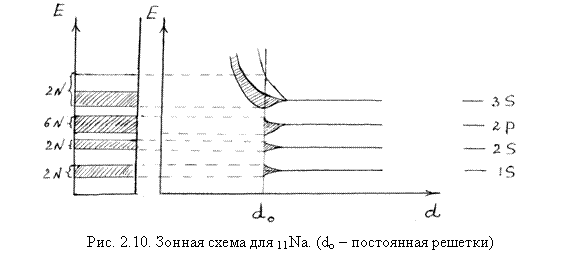
- 11Na. Каждый атом натрия содержит 11 электронов, распределенных по состояниям следующим образом: 1s22s22p63s1. При объединении атомов в кристалл энергетические уровни атомов превращаются в зоны. Электроны внутренних оболочек атома полностью заполняют зоны, образованные из уровней 1s, 2s и 2p, так как в них на 2N, 2N и 6N состояний приходятся соответственно 2N, 2N и 6N электронов. Валентная зона образована из 3s – состояний. В ней имеется всего 2N состояний, на которые приходится N электронов (по одному валентному электрону на атом), и валентная зона заполнена наполовину (рис. 2.10), то есть внешнее поле легко может изменить состояние электронов этой зоны. Поэтому Na и другие щелочные металлы (Li, K) обладают хорошей проводимостью.
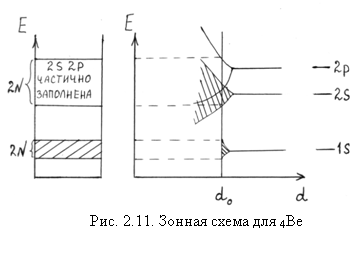
- 4Be. Электронная конфигурация атома бериллия 1s22s2. Зона 2s – последняя зона, содержащая электроны, заполнена полностью; однако следующая зона 2p свободна. При фактическом межатомном расстоянии do зоны 2s и 2p перекрываются, в результате чего образуется частично заполненная зона (рис. 2.9,б и рис. 2.11).
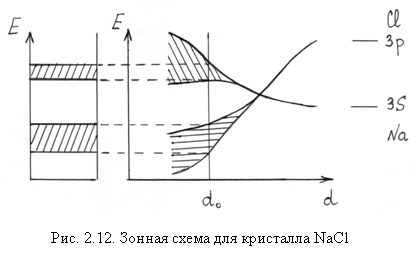
- Ионный кристалл NaCl. Положительно заряженные ионы натрия Na+ имеют электронную конфигурацию 1s22s22р6, а отрицательно заряженные ионы хлора Cl - 1s22s22р63s22р6. Зоны, образующиеся из полностью заполненных атомных уровней, тоже полностью заполнены. Последней заполненной зоной является зона 3р Cl-, а следующей за ней свободной зоной – зона 3s Na+. Энергетическая щель между этими зонами составляет около 9 эВ (рис. 2.12).
|