6. ОСНОВЫ РАВНОВЕСНОЙ ТЕРМОДИНАМИКИ
- Удельная теплоёмкость вещества:
![]() .
.
- Молярная теплоёмкость вещества:
![]() .
.
- Молярные теплоёмкости при постоянном объёме (
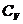 ) и постоянном давлении (
) и постоянном давлении (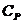 ):
):
![]()
![]() ,
,
где ![]() - число степеней свободы;
- число степеней свободы; ![]() .
.
- Связь между удельной
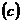 и молярной
и молярной 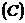 теплоёмкостями:
теплоёмкостями:
![]() ,
,
где ![]() – молярная масса.
– молярная масса.
- Внутренняя энергия идеального газа:
![]() .
.
- Полная работа при изменении объема газа:
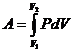 ,
,
где V1 и V2 - соответственно начальный и конечный объемы газа.
- Работа газа:
при изобарном процессе
![]() , или
, или ![]() ;
;
при изотермическом процессе
![]() , или
, или ![]() ;
;
при адиабатном процессе
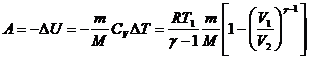 ,
,
где ![]() .
.
- Первое начало термодинамики:
![]() ,
,
где ![]() – количество теплоты, сообщённое системе;
– количество теплоты, сообщённое системе; ![]() - изменение внутренней энергии системы;
- изменение внутренней энергии системы; ![]() – работа, совершённая системой против внешних сил.
– работа, совершённая системой против внешних сил.
Если над системой совершается работа (![]() ), то первое начало термодинамики:
), то первое начало термодинамики:
![]() , причём
, причём ![]() .
.
- Первое начало термодинамики применительно к изопроцессам:
- изотермический (
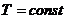 ):
): 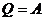 (
(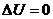 );
); - изохорный (
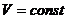 ):
): 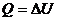 (
(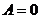 );
); - изобарный (
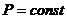 ):
): 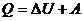 ;
; - адиабатный (
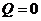 ):
): 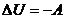 или
или 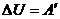 .
. - Уравнение Пуассона для адиабатного процесса:
![]() ,
, ![]() ,
, ![]() ,
,
где ![]() .
.
- Коэффициент полезного действия цикла Карно (рис.13), который состоит из двух изотерм и двух адиабат:
![]() ,
,
где ![]() – количество теплоты, полученное от нагревателя;
– количество теплоты, полученное от нагревателя; ![]() – количество теплоты, переданное холодильнику;
– количество теплоты, переданное холодильнику; ![]() – температура нагревателя;
– температура нагревателя; ![]() – температура холодильника; А - работа совершаемая за цикл.
– температура холодильника; А - работа совершаемая за цикл.
На рис. 13 изотермические расширение (1-2) и сжатие (3-4), адиабатические расширение (2-3) и сжатие (4-1).

- Изменение энтропии при равновесном переходе из состояния 1 в состояние 2:
![]() .
.
Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).