|
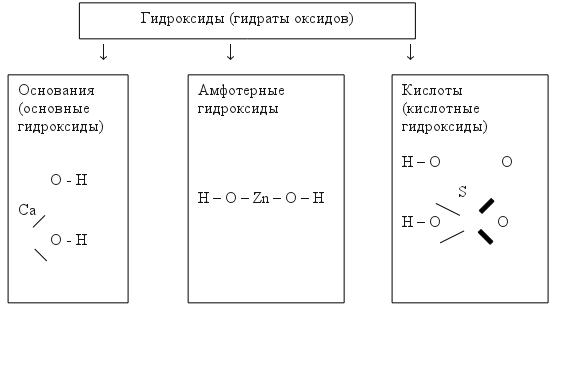
Занятие №5. Основания Задание 1. Читайте текст: Гидроксиды (гидраты оксидов) по химическим свойствам делят на основания, кислоты и амфотерные гидроксиды:
Обратите внимание: все гидроксиды содержат группы OH- . OH- Группа - это гидроксигруппа (гидроксидная группа), ее заряд = -1. ЗАПОМНИТЕ: Основания – это сложные вещества, молекулы которых состоят из атомов металла и гидрокси-групп ОН- Задание 2. Читайте формулы оснований: 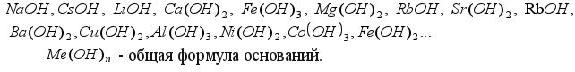
Названия оснований Обратите внимание: металл имеет постоянную степень окисления: 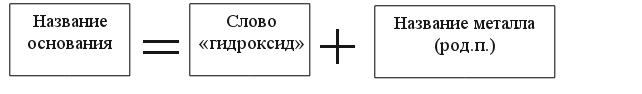
Пример: NaOH - гидроксид натрия Al(OH)3 - гидроксид алюминия. Обратите внимание: металл имеет переменную степень окисления: 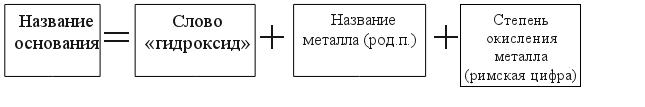
Пример: Fe(OH)2 - гидроксид железа (II) Fe(OH)3 - гидроксид железа (III) Степень окисления металла в молекуле основания определяет число гидрокси-групп OH- Обратите внимание: 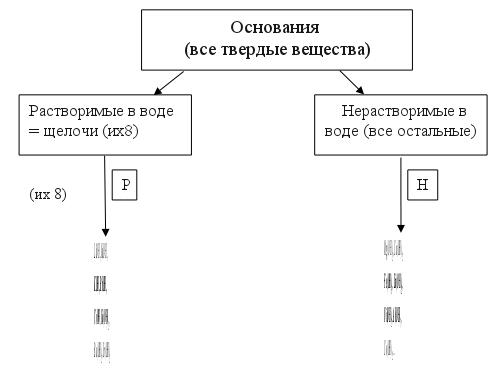
Обратите внимание: щелочи изменяют цвет индикаторов:
Получение оснований (смотрите таблицу 4) Растворимые основания (щелочи) можно получить по реакции 1)очень активного металла (их 8) с водой (реакция замещения): 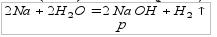
2)оксида активного металла (их 8) с водой: 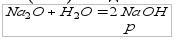
Нерастворимые основания можно получить по реакции 3)растворимой соли со щелочью (реакция обмена): 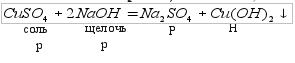
Химические свойства оснований (смотрите таблицу 4) 1. Все основания (растворимые и нерастворимые) реагируют с кислотами и дают соль и воду (реакция нейтрализации): 
Обратите внимание: в реакциях обмена (3) один из продуктов реакции должен быть нерастворимым. |