|
Классы неорганических соединений Занятие № 4 1. Классификация неорганических веществ. Оксиды. Задание 1. Читайте текст: Все вещества делятся на простые и сложные вещества. Простые вещества – это вещества, которые состоят из атомов одного элемента. Примеры: S,Ss,O2,P,C,Ca,W... Сложные вещества – это вещества, которые состоят из атомов разных элементов. Примеры:H2O,CaO,Al(OH)3 ,HCl,Na2SO4.... Сложные вещества делятся на классы: оксиды, основания, кислоты, амфотерные гидроксиды и соли (таблица 2). 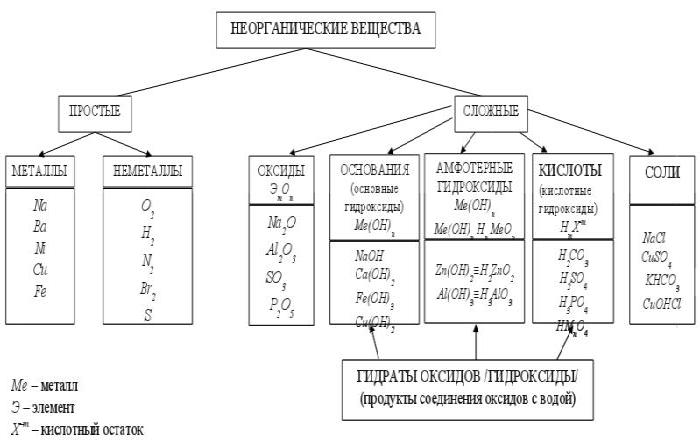
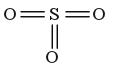
ОКСИДЫ Задание 2.Читайте формулы оксидов: K2O,BaO,Fe2O3,SO2,SO3,P2O5.... Эm+nOn-m - общая формула оксидов ЗАПОМНИТЕ: Оксиды – это сложные вещества, молекулы которых состоят из атомов кислорода и другого элемента (металла или неметалла). Названия оксидов Обратите внимание: элемент имеет постоянную степень окисления: 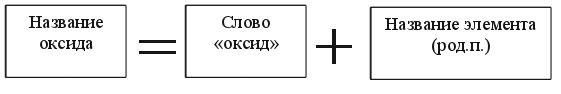
Примеры: Na2O-оксид(чего?) натрия Al2O3-оксид(чего?)алюминия Обратите внимание: элемент имеет переменную степень окисления: 
Примеры: FeO- оксид железа (II) SO2 - оксид серы (IV) Fe2O3 - оксид железа (III) SO3 SO3 - оксид серы (VI) - название читается: «оксид серы шесть». В графических формулах оксидов атомы кислорода соединяются только с атомами другого элемента и не соединяются между собой.
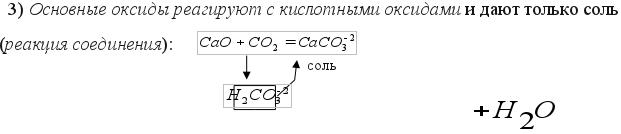
Получение оксидов (смотрите таблицу 3) Оксиды можно получить: 1)в результате реакции соединения простого вещества (металла и неметалла) с кислородом: 2Ca + O2=2CaO 4P + 5O2=2P2O5 2)в результате реакции разложения нерастворимых оснований при нагревании: Cu(OH)2 = CuO + H2O to 3)в результате реакции разложения нерастворимых солей при нагревании: CaCO3 = CaO + CO3 to ЗАПОМНИТЕ: По химическим свойствам оксиды делят на 3 группы: 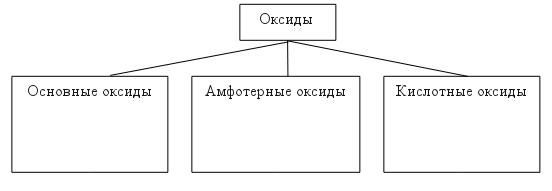
Химические свойства основных и кислотных оксидов (смотрите таблицу 3)
|