

|
Основные законы химии. Закон Авогадро. Молярный объем и относительные плотности газов. Задание 1. Читайте текст: В 1811 г. итальянский ученый Амедео Авогадро открыл закон (для газов), который называется законом Авогадро. ЗАПОМНИТЕ! Закон Авогадро: В равных объемах (V) разных газов при одинаковых условиях (Т, Р) содержится равное число молекул (N). Объем газа зависит от температуры (Т) и давления (Р). Размеры молекул газа очень маленькие, а расстояния между молекулами большие. То есть объем газа определяется не размером его молекул, а расстояниями между ними. При одинаковой температуре и давлении молекулы газа находятся на равных расстояниях. Поэтому равное число молекул занимает одинаковый объем. Если V1=V2,T1=T2,p1=p2, то N1=N2, где V1,T1,p1,N1-бъем, температура, давление и число молекул одного газа; V2,T2,p2,N2-бъем, температура, давление и число молекул другого газа; ЗАПОМНИТЕ! Первое следствие из закона Авогадро: Равное число молекул (N) разных газов при одинаковых условиях (Т, Р) занимает равные объемы (V). Если N1=N2,T1=T2,p1=p2, то V1=V2 Один моль (1 моль) любого газа содержит 6,02*1023 молекул, и при одинаковых условиях газы будут занимать равные объемы. Рассчитаем объем одного моля газа при нормальных условиях. Нормальные условия (н.у.): температура Т = 00С; давление Р=760 мм ртутного столба (или 101325 Па) 
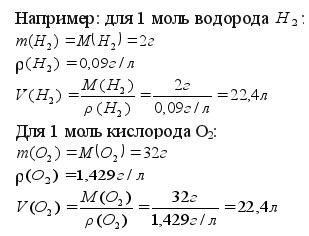
Из этого можно сделать вывод, что 1 моль любого газа при нормальных условиях занимает постоянный объем 22,4 л. Этот объем называется молярным объемом Vm=22,4л/моль Молярный объем V m - это постоянная величина для всех газов при н.у. ЗАПОМНИТЕ: Молярный объем Vm любого газа при н.у. равен 22,4 л/ моль. Если известен объем газа при нормальных условиях, то можно определить количество вещества: 
Второе следствие из закона Авогадро Второе следствие из закона Авогадро используется для расчета относительных плотностей газов. Плотность любого газа (при н.у.) можно определить по формуле: 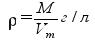
M - молярная масса газа (г/моль); Vm - молярный объем газа (л/моль). Если плотность одного газа а плотность второго газа то отношение плотностей p 1 и p2 называется относительной плотностью одного газа по другому газу (D):
ЗАПОМНИТЕ! Второе следствие из закона Авогадро: Относительная плотность одного газа по другому газу D равна отношению их молярных масс. Обратите внимание: Относительная плотность газа показывает, во сколько раз молярная масса одного газа больше, чем молярная масса другого газа. Относительную плотность газа можно определить по водороду или по воздуху DH. Относительную плотность газа по водороду DH. 
Относительную плотность газа по воздуху Dвозд. 
Из этих формул можно определить молярную массу газа: 
Задание 2. Ответьте на вопросы:
Домашнее задание. Сделайте упражнения и решите задачи: 1. Какой объем при н.у. занимают а) 20 г аргона Ar , б) 7,4 хлора Cl2, в) 40 г метана CH4 , г) 0,85 г NH3, д) 1,4 кг азота N2? 2. Чему равна масса а) 1 л водорода H2, б) 1 л кислорода O2 , в) 1м3 углекислого газа CO2 (объемы газов даны при н.у.) 3. Рассчитайте относительные плотности по водороду и по воздуху следующих газов: а) метана CH4 , б) кислорода O 2, в) хлороводорода HCl . 4. Некоторый газ массой 10 г при н.у. занимает объем 5,6 л. Определите молярную и относительную молекулярную массы этого газа. 5. Определите молярную массу газа, относительная плотность которого а) по водороду равна 32, б) по воздуху равна 2,45, в) по аргону Ar равна 0,43. |

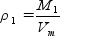 ,
,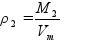 ,
,